1、实验题 用长度放大600倍的显微镜观察布朗运动,估计放大后的小颗粒(碳)体积为0.1×10-9 m3,碳的密度是2.25×103 kg/m3,摩尔质量是1.2×10-2 kg/mol,阿伏加德罗常数为6.02×1023 mol-1,则该小碳粒含分子数约为__________个(取一位有效数字),所以布朗运动不是分子运动.
参考答案:5×1010
本题解析:实际碳颗粒的体积为
V=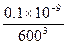 ?m3
?m3
碳颗粒的质量为
m= ?kg
?kg
碳颗粒的物质的量为
n= ?mol
?mol
碳颗粒的个数为
N= ×6.02×1023个≈5×1010个.
×6.02×1023个≈5×1010个.
本题难度:简单
2、简答题 已知金刚石的密度是3.5× ,摩尔质量M=
,摩尔质量M= .试估算金刚石内碳原子间的平均距离(结果保留两位有效数字).
.试估算金刚石内碳原子间的平均距离(结果保留两位有效数字).
参考答案:1.8×
本题解析:
方法一 取质量为1kg的金刚石,根据公式ρ=m/V得其所占体积为
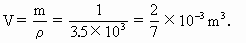
由金刚石的摩尔质量M= 得:1kg金刚石中所含碳原子的个数
得:1kg金刚石中所含碳原子的个数

由于固体分子之间的空隙很小,我们可以认为组成金刚石的碳原子是一个挨着一个紧密排列的,因此,每个碳原子所占的体积为
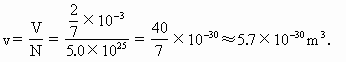
将碳原子看成立方体模型,则该立方体的棱长便是碳原子间距离d的平均值,即
? ≈1.8×
≈1.8× .
.
方法二 取体积为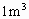 的金刚石,根据公式ρ=m/V得这样一块金刚石的质量
的金刚石,根据公式ρ=m/V得这样一块金刚石的质量
m=ρV=3.5×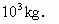
由金刚石的摩尔质量M=12× 得
得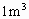 (即3.5×
(即3.5× )的金刚石中所含碳原子个数为
)的金刚石中所含碳原子个数为
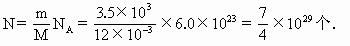
一个碳原子所占的体积为
v=V/N= =5.7×
=5.7× (认为碳原子一个挨一个紧密排列).
(认为碳原子一个挨一个紧密排列).
将碳原子看成立方体模型,故碳原子间距离d=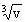 =1.8×
=1.8× m.
m.
思路点拨:此类估算问题的解题思路是:先设取一定质量的金刚石算出其体积(或设取一定体积的金刚石算出其质量),再借助摩尔质量和阿伏加德罗常数算出一个碳原子的体积,最后,依据原子模型(球模型或正方体模型)求出原子间的平均距离.
小结:本题重点考查解决估算问题的能力.解决这类问题离不开下面的三个假设与近似:其一,设固体分子一个挨着一个紧密排列(即假设固体分子间没有空隙);其二,假设分子模型为立方体模型,这种假设可以简化运算,本题若将原子按球模型处理,则根据公式


即分子间的平均距离为2.2× ,与按照立方体模型估算的结果非常接近;其三,在求
,与按照立方体模型估算的结果非常接近;其三,在求 的值时,采用“试幂法”,即倒着算.
的值时,采用“试幂法”,即倒着算.
本题难度:简单
3、选择题 已知某气体的摩尔体积为VA,摩尔质量为MA,阿伏加德罗常数为NA,则根据以上数据可以估算出的物理量是 ( )
A.分子质量
B.分子体积
C.分子密度
D.分子间平均距离