微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中,正确的是( )
A.0.1mol?L-1的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小
B.体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少
C.若常温下H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,则
H+(aq)+NH3?H2O(aq)=
(aq)+H2O(l)△H=-57.3kJ?mol-1
D.少量NaHSO4溶液与足量Ba(OH)2溶液反应离子方程式为:2H+++Ba2++2OH-=BaSO4↓+2H2O
参考答案:A、醋酸稀释时,能促进醋酸的电离,导致电离程度增大,但氢离子浓度降低,温度不变水的离子积是常数,所以氢离子浓度增大,故A错误.
B、pH相同的NH4Cl溶液、盐酸,氢离子浓度相同,和锌粉刚开始反应时,二者反应速率相同;随着反应的进行,盐酸反应中的氢离子浓度逐渐减少,氯化铵溶液中存在水解平衡,铵根离子水解的氢离子补充和锌反应的氢离子,导致氯化铵溶液中氢离子浓度始终大于盐酸溶液中的,所以和氯化铵反应的锌反应速率大于和盐酸反应的速率,即前者用时少,故B正确.
C、氨水是弱电解质,弱电解质的电离是吸热的,导致强酸和氨水反应放出的热量小于57.3kJ?mol-1,故C错误.
D、少量NaHSO4溶液与足量Ba(OH)2溶液反应生成硫酸钡和氢氧化钠、水,离子方程式为:H++SO2-4+Ba2++OH-=BaSO4↓+H2O,故D错误.
故选B.
本题解析:
本题难度:一般
2、选择题 下列反应的离子方程式书写正确的是( )
A.铝溶于NaOH溶液:2Al+2OH-+H2O═2AlO2ˉ+3H2↑
B.氧化铝溶于足量NaOH溶液:Al2O3+OH-═AlO2ˉ+H2O
C.向氢氧化铝沉淀中加入足量盐酸:Al(OH)3+3H+═Al3++3H2O
D.向氯化铝溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2ˉ+4NH4+
参考答案:A、金属铝既能和强酸反应又能和强碱反应,和氢氧化钠发生反应的实质是:2Al+2OH-+2H2O═2AlO2ˉ+3H2↑,故A错误;
B、氧化铝是两性氧化物,能和强酸以及强碱反应,和强碱氢氧化钠反应的离子方程式为:
Al2O3+2OH-═2AlO2ˉ+H2O,故B错误;
C、氢氧化铝和盐酸发生中和反应生成氯化铝和水,实质是:Al(OH)3+3H+═Al3++3H2O,故C正确;
D、向氯化铝溶液中滴加过量氨水可以获得氢氧化铝沉淀,氢氧化铝不能和弱碱发生反应,向氯化铝溶液中滴加过量氨水的反应为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故D错误.
故选C.
本题解析:
本题难度:简单
3、选择题 下列离子方程式书写正确的是
A.FeCl2溶液中通入Cl2:Fe2++Cl2====Fe3++2Cl-
B.Ba(OH)2溶液与硫酸的反应:OH-+H+====H2O
C.偏铝酸钠溶液中滴加过量盐酸: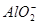 +4H+====Al3++2H2O
+4H+====Al3++2H2O
D.AlCl3溶液中加入过量氨水:Al3++4OH-====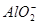 +2H2O
+2H2O
参考答案:C
本题解析:A不正确,电子的得失不守恒;B不正确,还有硫酸钡产生;D不正确,氢氧化铝不能溶于氨水中,所以正确的答案选C。
本题难度:简单
4、选择题 下列表示对应化学反应的离子方程式正确的是( )。
A.向AlCl3溶液中加入过量浓氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B.将含有0.1 mol Ba(OH)2的溶液与含有0.2 mol NaHSO4的溶液混合:H++SO42-+OH-+Ba2+=BaSO4↓+H2O
C.向澄清石灰水中通入过量CO2:OH-+CO2=HCO3-
D.Na2O2溶于水:2O22-+2H2O=4OH-+O2↑
参考答案:C
本题解析:Al(OH)3不能溶解在氨水中,A错;由题目数据NaHSO4中H+可反应完但SO42-有剩余,二者的化学计量数相同,B错;D中Na2O2不能写成离子形式,D错。
本题难度:简单
5、填空题 写出下列反应式,并作简要回答:
(1)写化学方程式:
①呼吸面具中CO2与过氧化钠反应:______.
②工业生产漂白粉:______.
③加热的浓硫酸与木炭反应:______.其中氧化剂是______(写化学式),还原产物是______(写化学式).
(2)写离子方程式:
①烧碱溶液与铝片的反应:______.
②烧碱溶液与磨口玻塞中的SiO2的反应:______.
③稀硝酸与铜片的反应:______,若有2molHNO3被还原,则有______mol电子转移.
参考答案:(1)①过氧化钠可以和二氧化碳反应生成碳酸钠和氧气,即2Na2O2+2CO2═2Na2CO3+O2↑,
故答案为:2Na2O2+2CO2═2Na2CO3+O2↑;
②工业上将氯气通到石灰乳中来生产漂白粉,原理是:2Cl2+2Ca(OH)2?△?.?CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2?△?.?CaCl2+Ca(ClO)2+2H2O;
③浓硫酸具有强氧化性,能和非金属单质碳加热时反应,即C+2H2SO4(浓)═CO2↑+2SO2↑+2H2O,化合价降低的元素是硫酸中的硫元素,对应的产物是二氧化硫,所以H2SO4是氧化剂,SO2是还原产物,
故答案为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O;H2SO4;SO2;
(2)①金属铝能和烧碱反应生成氢气,实质是:2Al+2OH-+2H2O═2?AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2?AlO2-+3H2↑;
②二氧化硅是酸性氧化物,能和氢氧化钠反应生成盐和水,即SiO2+2OH-═SiO32-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O;
③硝酸具有氧化性,稀硝酸对应的还原产物是一氧化氮,反应实质为:2NO3-+3Cu+8H+═3Cu2++2NO↑+4H2O,反应中有8mol的硝酸参加反应,只有2mol的硝酸做氧化剂被还原,反应转移电子为6mol,
故答案为:2NO3-+3Cu+8H+═3Cu2++2NO↑+4H2O;6.
本题解析:
本题难度:一般