微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列比较正确的是(? )
A.离子半径:Al3+>O2-
B.与水反应的激烈程度:Al>Mg
C.热稳定性:HF>NH3
D.单质的氧化性:S>O2
参考答案:C
本题解析:核外电子排布相同的微粒其微粒半径随原子序数的增大而减小,A不正确,离子半径:Al3+<O2-;同周期自左向右,金属性逐渐减弱,非金属性逐渐增强,所以选项B不正确,与水反应的激烈程度:Al<Mg。非金属性越强,氢化物的稳定性越强,C正确;同主族自上而下非金属性逐渐减弱,则选项D不正确,单质的氧化性:S<O2,答案选C。
点评:该题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确元素周期律的含义,然后结合题意灵活运用即可。
本题难度:一般
2、选择题 下列关于氢原子电子云的说法正确的是(?)
A.小黑点的疏密表示电子在核外空间单位体积内的多少
B.小黑点的疏密表示电子在核外空间出现机会的多少
C.氢原子核外有一层带负电荷的电子
D.每个小黑点表示电子在某一时刻在该空间出现一次
参考答案:D
本题解析:电子云是用统计的方法对核外电子运动规律所作的一种描述,电子云的密或疏表示电子在核外空间单位体积内出现机会的多少。小黑点不代表电子,小黑点的疏密是个密度。A、C把小黑点当成具体的电子,B没有指明单位体积,只有D正确。
本题难度:简单
3、选择题 某短周期元素原子最外层只有2个电子,则该元素(?)
A.一定是第ⅡA族元素
B.一定是金属元素
C.一定是化合物中呈+2价元素
D.可能是金属元素,也可能是非金属元素
参考答案:D
本题解析:元素原子最外层只有2个电子,若为主族元素则在周期表中处于第ⅡA族,为金属元素,在化合物中呈+2价,若为He,则为0族元素。
本题难度:一般
4、计算题 某元素的同位素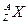 ,它的氯化物XCl21.11 g溶于水制成溶液后,加入1 mol·L-1的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子。求:
,它的氯化物XCl21.11 g溶于水制成溶液后,加入1 mol·L-1的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子。求:
(1)Z值和A值。
(2)X元素在周期表中的位置。
(3)把X的单质放入水中,有何现象?写出反应的化学方程式。
参考答案:
(1) =20,
=20, =40。(2)第四周期,ⅡA族。(3)有气泡产生。Ca+2H2O
=40。(2)第四周期,ⅡA族。(3)有气泡产生。Ca+2H2O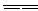 Ca(OH)2+H2↑。
Ca(OH)2+H2↑。
本题解析:
Ag++Cl-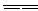 AgCl
AgCl
1 1?
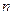 ?(Ag+)="1" mol·L-1×0.02 L
?(Ag+)="1" mol·L-1×0.02 L
所以 (Cl-)=" 0.02" mol
(Cl-)=" 0.02" mol
 (XCl2)=" 0.01" mol
(XCl2)=" 0.01" mol
 (XCl2)=" 111" g·mol-1
(XCl2)=" 111" g·mol-1
 (X)= 111-71=40
(X)= 111-71=40
则 =40,
=40, =20,该元素是Ca
=20,该元素是Ca
本题难度:一般
5、选择题 根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是? (? )
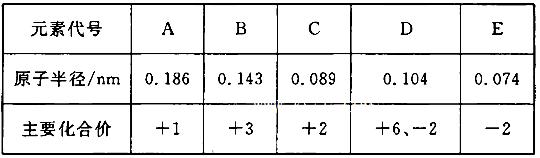
A.E2-与B3+的核外电子数不可能相等
B.离子半径大小A+<E2-
C.最高价氧化物对应水化物的碱性A<C
D.氢化物的稳定性H2D>H2E
参考答案:B
本题解析: 由表中数据可知A为钠,B为铝,C为铍,D为硫,E为氧。A. E2-与B3+的核外电子数都是10,相等,错误。 B.离子半径大小A+<E2-,正确。 C.钠比铝活泼,故最高价氧化物对应水化物的碱性C<A,错误。 D.元素的非金属性越强其对应氢化物的稳定性越稳定,应该是H2E>H2D,错误。
本题难度:一般