微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是(?)
A.难失去电子的原子,易形成阴离子
B.单质分子中不存在化学键,化合物的分子才存在化学键 ()
C.离子化合物中一定含有离子键
D.离子化合物中一定含金属键
参考答案:C
本题解析:A.例如稀有气体元素,具有最稳定的外层结构,不易失去电子,也不易得到电子,所以A不正确。
B.双原子单质分子存在化学键比如O2、N2等单质中存在共价键,不是分子构成的单质也存在化学键比如Fe、Cu存在金属键。单原子分子中不存在化学键比如稀有气体,所以B不正确。
C.离子化合物中一定含有离子键,可能含有共价键,所以C正确。
D.含铵根离子的离子化合物中不含金属键,所以D不正确。
故选C。
点评:本题考查离子键和共价键的比较,题目难度中等。
本题难度:一般
2、选择题 最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1molN-N键吸收167kJ热量,从氮原子生成1molN≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是
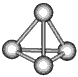
[? ]
A.N4属于一种新型的化合物
B.1molN4气体转变为N2会吸收882kJ热量
C.N4沸点比P4(白磷)高
D.1molN4气体转变为N2会放出882kJ热量
参考答案:D
本题解析:
本题难度:一般
3、填空题 A、B、C、X、Y、Z元素的原子序数依次增大,根据信息完成问题:
元素A
| 各能级上的电子数相等
|
元素C
| 某种核素原子的质量数为18,中子数为10
|
元素X
| 单质是良好的半导体材料
|
元素Y
| 其单质为淡黄色晶体,常用来处理打碎的水银温度计
|
元素Z
| 3d能级上有4个未成对电子
|
(1)Z元素在周期表中的位置 ,其电子排布式 。
(2)AO2的熔点远低于XO2熔点的主要原因是 。
(3)X的氧化物和NaOH溶液反应的化学方程式 。
(4)B、C气态基态原子的第一电离能的大小关系为 。
(5)请用离子方程式表达Na2Y溶液呈碱性的原因 。
(6)已知CH3COOH(aq) H+(aq)+CH3COO—(aq) △H=+akJ/mol
H+(aq)+CH3COO—(aq) △H=+akJ/mol
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) △H=—bkJ/mol
则中和热的△H= kJ/mol
参考答案:(1)第四周期第Ⅷ族 (2分) 1s22s22p63s23p63d64s2 或[Ar]3d64s2 (2分)
(2)SiO2形成的是原子晶体,CO2形成的是分子晶体(2分)
(3)SiO2+2NaOH=Na2SiO3+H2O (2分)(4)N>O (2分)
(5)S2—+H2O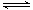 HS—+OH— HS—+H2O
HS—+OH— HS—+H2O H2S+OH—(2分)
H2S+OH—(2分)
(6)—(a+b)(2分)
本题解析:根据各能级上的电子数相等可推出A为C元素;根据某种核素原子的质量数为18,中子数为10可推出质子数为8,则C为O元素;根据原子序数依次增大可推出B为N元素;元素X的单质是良好的半导体材料,说明X为Si元素;元素Y的单质为淡黄色晶体,常用来处理打碎的水银温度计,说明Y为S元素;3d能级上有4个未成对电子,则Z为Fe。
(1)Z元素为Fe,在元素周期表中位于第四周期 Ⅷ族;电子排布式为:1s22s22p63s23p63d64s2。
(2)CO2形成分子晶体,分子间以分子间作用力结合,SiO2是原子晶体,原子间以共价键结合,共价键作用远远大于分子间作用力,所以CO2的沸点远低于SiO2的沸点。
(3)SiO2为酸性氧化物,与NaOH反应生成Na2SiO3和H2O:SiO2+2NaOH=Na2SiO3+H2O
(4)N原子2P轨道排布3个电子,为半充满状态,为较稳定状态,失电子较难,所以第一电离能:N>O
(5)S2?水解使溶液显碱性:S2—+H2O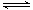 HS—+OH— HS—+H2O
HS—+OH— HS—+H2O H2S+OH—
H2S+OH—
((6)中和热为反应:H++OH?=H2O的?H,根据盖斯定律,?H=-?H1+?H2=—(a+b)kJ?mol?1。
考点:本题考查元素的推断、电子排布、沸点的比较、方程式的书写、盖斯定律的应用。
本题难度:困难
4、选择题 已知反应:H2S(g)+aO2(g)=X+cH2O(l) ΔH,若ΔH表示该反应的标准燃烧热,则X为
A.S(s)
B.SO2(g)
C.SO3(g)
D.SO3(l)