|
高中化学知识点归纳《化学反应与能量》试题预测(2017年最新版)(八)
2017-08-09 23:49:45
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下叙述不正确的是?(?)
A.在水中氢、氧原子间的作用力只有共价键
B.金属和非金属化合既可能形成离子键,也可能形成共价键
C.离子键是阴、阳离子之间的静电吸引和静电排斥共同作用的结果
D.H2、Cl2反应,首先H2、Cl2分子的共价键断裂成H、Cl原子,而后H、C1间形成离子键
| ?
参考答案:
AD
本题解析:
A选项水分子内氢原子与氧原子间以化学键相结合,分子间H、O原子间存在氢键。D选项中氢、氯原子之间只形成共价键。
本题难度:一般
2、选择题 下列说法正确的是
A.离子晶体中,一个阴离子可同时与多个阳离子间有静电作用
B.离子化合物中的阳离子,只能是金属离子
C.凡金属跟非金属元素化合时都形成离子键
D.溶于水可以导电的化合物一定是离子化合物
参考答案:A
本题解析:B:氯化铵中的阳离子为NH4+;C:氯化铝中存在的是共价键是;D:共价化合物HCl溶于水全部电离,可导电。
本题难度:一般
3、选择题 下列物质中既含有离子键又含有共价键的是( )
A.NaOH
B.NaCl
C.H2O
D.NH4Cl
参考答案:A、钠离子和氢氧根之间是离子键,氢氧根内部存在共价键,故A正确;
B、氯化钠中只存在钠离子和氯离子之间的离子键,故B错误;
C、水分子中只有共价键,故C错误;
D、所有的铵盐中既有离子键又有共价键,故D正确.
故选AD.
本题解析:
本题难度:一般
4、填空题 (9分)依据叙述,写出下列反应的热化学方程式。
(1)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为____________________________________________________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为____________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为__________________________________________________。
参考答案:(1)N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1
(2)C2H2(g)+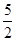 O2(g)===2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1 O2(g)===2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
(3)N2(g)+3H2(g) 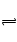  2NH3(g) ΔH=-92 kJ·mol-1 2NH3(g) ΔH=-92 kJ·mol-1
本题解析:
试题解析:(1)适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=67.8kJ?mol-1;(2)适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=67.8kJ?mol-1;(3)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,所以有10NA个电子转移时,放出1300kJ的热量,则热化学方程式为:C2H2(g)+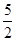 O2(g)→2CO2(g)+H2O(l)△H=-1300kJ?mol-1; O2(g)→2CO2(g)+H2O(l)△H=-1300kJ?mol-1;
(4)在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,所以热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ?mol-1.
考点:热化学方程式
本题难度:一般
5、选择题 下列各组物质中化学键类型和晶体类型都相同的是( )
A.氯化钠和碳酸钠
B.二氧化碳和二氧化硅
C.碘和白磷
D.铜和氧化铜
参考答案:A、氯化钠和碳酸钠都是离子晶体,氯化钠中只含离子键,碳酸钠中既含离子键又含共价键,故A错误;
B、固体二氧化碳是分子晶体,二氧化硅是原子晶体,二氧化硅、二氧化碳都只含共价键,故B错误;
C、碘和白磷都是分子晶体,都只含共价键,故C正确;
D、铜是金属晶体,氧化铜是离子晶体,铜中含有金属键,氧化铜中含有离子键,故D错误;
故选C.
本题解析:
本题难度:一般
|