微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)今有2H2+O2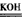 2H2O反应,构成燃料电池, 则负极通的应是____,正极通的应是____,电极反应式为____、____。
2H2O反应,构成燃料电池, 则负极通的应是____,正极通的应是____,电极反应式为____、____。
(2)如把KOH改为稀硫酸作电解质,则电极反应式为 ____、____。(1)和(2)的电解液不同,反应进行后,其溶液的pH各有何变化?_____,_____。
(3)如把H2改为甲烷,KOH作导电物质,则电极反应式为____,____。
参考答案:(1)H2 ;O2 ;负极:2H2+4OH--4e-=4H2O ;正极:O2+2H2O+4e-=4OH-
(2)负极:2H2-4e-=4H+? ;正极:O2+4H++4e-= 2H2O ;?(1)中pH先变小,后变大;(2)中pH变大
(3)负极:CH4+10OH--8e-=CO32- +7H2O? ;正极:2O2+4H2O+8e-=8OH-
本题解析:
本题难度:一般
2、选择题 X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸银溶液中,Y表面有Z析出。其活泼顺序是
A.X>Y>Z
B.Z>Y>X
C.X>Z>Y
D.Y>X>Z
参考答案:A
本题解析:原电池中较活泼的金属做负极,X、Y组成原电池,X是负极,则金属性是X大于Y;活泼的金属能置换出不活泼的金属,所以把Y放在Z的硝酸银溶液中,Y表面有Z析出,说明金属性是Y大于Z,所以X、Y、Z三种金属的活泼性是X>Y>Z,答案选A。
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。明确金属性强弱比较的判断依据,是答题的关键,有利于培养学生的逻辑推理能力。
本题难度:简单
3、选择题 有关如下图所示原电池的叙述正确的是(盐桥中装有含琼胶的KCl饱和溶液)
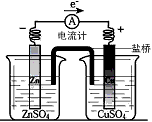
[? ]
A.铜片上有气泡逸出
B.取出盐桥后,电流计依然发生偏转
C.反应中,盐桥中的K+会移向CuSO4溶液
D.反应前后铜片质量不改变
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列装置能够成原 电池的是
电池的是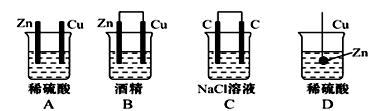
参考答案:D
本题解析:略
本题难度:简单
5、填空题 下列装詈能否组成原电池?并判断其正负极。
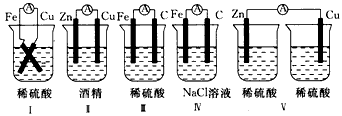
______________________________________
参考答案:I能,Fe为负极,Cu为正极
Ⅱ不能
Ⅲ能,Fe 为负极,C为正极
IV能,Fe为负极,C为正极
V不能
本题解析:
本题难度:一般