微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 结合SO2的特点,分析以下对SO2的物质分类及其性质的预测中,不正确的是
①碱性氧化物? 可与烧碱反应生成盐和水②非电解质?熔融状态不导电
③电解质?水溶液能导电?④酸性氧化物?可与水反应生成酸
A.①②
B.③④
C.①③
D.②④
参考答案:C
本题解析:①.错误。SO3是酸性氧化物,可与烧碱反应生成盐和水。②.正确。SO3是非电解质,因为熔融SO3不导电,SO3溶液导电,说明硫酸是电解质。③.错误。SO3是非电解质,SO3溶液导电,说明硫酸是电解质。④.正确。SO3是酸性氧化物,与水反应得到H2SO4。故选C。
点评:电解质和非电解质都是化合物电解质,电解质是指在水溶液中或熔融状态下能够导电的化合物,例如酸、碱和盐等。凡在上述情况下不能导电的化合物叫非电解质,例如蔗糖、酒精等其他的(也就是单质)都既不是电解质也不是非电解质。
本题难度:一般
2、选择题 将下列物质按酸、碱、盐、氧化物分类排列,正确的是
A.硫酸、纯碱、石膏、臭氧
B.硝酸、烧碱、绿矾、干冰
C.碳酸、乙醇、醋酸钠、水
D.磷酸、熟石灰、苛性钾、过氧化钠
参考答案:B
本题解析:A错误,纯碱不是碱,臭氧是单质,不是氧化物。
B正确。
C错误,乙醇是有机物,不是碱。
D错误,苛性钾是氢氧化钾,是碱不属于盐。
本题难度:一般
3、选择题 为减少大气污染,许多城市推广清洁燃料,目前使用的清洁燃料主要有两类:一类是压缩天然气(CNG),另一类是液化石油气。这两类燃料的主要成分是?
A.碳水化合物
B.碳氢化合物
C.氢气
D.醇类
参考答案:B
本题解析:压缩天然气(CNG)或液化石油气的主要成分都是碳氢化合物,答案选B。
点评:该题是基础性试题的考查,试题贴近生活,易于调动学生的学习兴趣。该题难度不大,记住即可。
本题难度:简单
4、选择题 某合作学习小组讨论辨析以下说法:①粗盐和碱石灰都是混合物;②沼气和水煤气都是可再生资源;③冰和水混合物不是混合物而是纯净物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和烧碱都是碱;⑦豆浆和雾都是胶体。上述说法正确的是(?)
A.①③④⑦
B.①②⑤⑥
C.③⑤⑥⑦
D.①②③④
参考答案:A
本题解析:水煤气是通过煤炭与水作用,当煤炭用完的时候也就是水煤气结束的时候,所以不是可再生的,②不正确,盐酸和食醋都是混合物,⑤不正确,纯碱是碳酸钠,是盐⑥不正确,所以答案选A。
本题难度:一般
5、填空题 铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是?。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:?。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是?;②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得21.525g白色沉淀。则溶液中c(Cl-)=?mol·L-1。
③验证该溶液中含有Fe2+,正确的实验方法是?。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
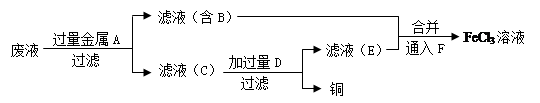
①滤渣C的化学式为?。
②加过量D发生反应的离子方程式为?。
③通入F发生反应的化学方程式为?。
参考答案:(1)用平行光照射两种分散系(或丁达尔现象)
(2)2Fe3++Cu=2Fe2++Cu2+
(3)①Fe3+、Fe2+、Cu2+?②3 ?③B
(4)①Fe、Cu?②Fe+2H+=Fe2++H2↑?③2FeCl2+Cl2=2FeCl3
本题解析:(1)胶体会产生丁达尔效应,但是溶液不能。因此鉴别Fe(OH)3胶体和FeCl3溶液的方法是用平行光照射两种分散系(或丁达尔现象)。(2)FeCl3有氧化性,能把铜氧化为Cu2+。反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+。(3)①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是Fe3+;由于发生了反应2Fe3++Cu=2Fe2++Cu2+,所以溶液中还含有Fe2+、Cu2+。②n(AgCl)= n(Cl-)=21.525g÷143. 5g/mol="0.15mol." 则溶液中c(Cl-)=n(Cl-)÷V=0.15mol÷0.05L=3mol/L。③A.因为溶液中含有Fe3+,Fe3+的黄色要比Fe2+的浅绿色深,所以无法看出该现象。错误。B.Fe2+有还原性,容易被酸性高锰酸钾溶液氧化而使之褪色。因此若看到溶液褪色,证明含有Fe2+。正确。C.原溶液中含有Fe3+,所以无论是否滴入氯水,都会发生该现象。错误。因此正确选项为B。(4)向反应后的溶液中加入过量的金属Fe,发生反应:Fe+CuCl2=FeCl2+Cu,,然后过滤得到滤液B中含有FeCl2;滤渣C中含有Fe、Cu。向滤渣中加入过量的盐酸,发生反应:Fe+2HCl= FeCl2+ H2↑. 离子方程式为:Fe+2H+= Fe2++H2↑。滤液E中含有FeCl2,将其与滤液B混合,然后向该溶液中滴加新制的过量的氯水,发生反应2FeCl2+Cl2=2FeCl3。最后得到FeCl3溶液。
本题难度:简单