微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某二元酸H2A在水溶液中发生电离:H2A?H++HA-,HA-?H++A2-.下列叙述不正确的是( )
A.在NaHA溶液中一定是:c(Na+)>c(HA-)>c(OH-)>c(H+)
B.在Na2A溶液中一定是:c(Na+)>c(A2-)>c(OH-)>c(H+)
C.在NaHA溶液中一定是:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)
D.在H2A溶液中一定是:c(H+)=c(HA-)+2c(A2-)+c(OH-)
参考答案:A、二元酸H2A在水溶液中发生电离:H2A?H++HA-,HA-?H++A2-.说明是二元弱酸,HA-离子存在两种趋势,电离和水解,电离大于水解溶液显酸性,水解大于电离溶液显碱性,故A错误;
B、在Na2A溶液中A2-离子水解溶液显碱性,溶液中离子浓度一定是:c(Na+)>c(A2-)>c(OH-)>c(H+),故B正确;
C、在NaHA溶液中存在阳离子是Na+、H+,阴离子HA-、A2-、OH-,溶液中电荷守恒一定是:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),故C正确;
D、在H2A溶液中阳离子H+,阴离子HA-、A2-、OH-,溶液中存在电荷守恒一定是:c(H+)=c(HA-)+2c(A2-)+c(OH-),故正确;
故选A.
本题解析:
本题难度:一般
2、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:

(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸____。
(2)不考虑其他组的实验结果,单从乙组情况分析,c是否一定等于0.2____(填“是”或“否”)。混合液中离子浓度c(A-)与c(Na+)的大小关系是________。
(3)由丙组实验结果分析,HA是____酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=____mol·L-1。 写出该混合溶液中下列算式的精确结果(不能做近似计算)。 c(Na+)-c(A-)=____mol·L-1? c(OH-)-c(HA)=____mol·L-1
参考答案:(1)若a=7,则HA是强酸,若a>7,则HA是弱酸
(2)否; c(A-)=c(Na+)
(3)弱; c(Na+)>c(A-)>c(OH-)>c(H+)
(4)10-5 ;10-5-10-9; 10-9
本题解析:
本题难度:一般
3、选择题 下列说法中正确的是
? [? ]
A.NaHCO3溶液中可以大量存在NO3-、Al3+、K+、SO42-等离子
B.t℃时,水的离子积常数为KW,则c2(OH-)=KW的水溶液一定呈中性
C.室温下0.1 mol/L的NaOH溶液与pH =1的某酸HA等体积混合后,溶液中c(Na+)≥c(A-)
D.1 mol/L的醋酸溶液加水稀释时,醋酸根离子的物质的量浓度与醋酸分子的物质的量浓度之比减小
参考答案:B
本题解析:
本题难度:一般
4、选择题 某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子.则下列描述正确的是( )
A.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液可由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+?)>c(OH-)>c(H+?)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+?)、c(NH4+)之和
参考答案:A
本题解析:
本题难度:一般
5、选择题 常温下,一定体积pH=2的二元弱酸H2R溶液与一定体积pH=12的NaOH溶液混合后溶液呈中性。该混合溶液中,离子浓度关系正确的是?
[? ]
A.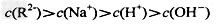
B.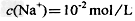
C.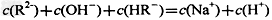
D.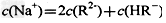
参考答案:D
本题解析:
本题难度:一般