微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )
A.一个NH5分子中含5个N-H键
B.NH5中既有共价键,又有离子键
C.NH5的电子式是
D.它与HCl反应的离子方程式为NH5+H+=NH4++H2↑
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列物质中含有非极性共价键的离子化合物是?(? )
A.Cl2
B.Na2O2
C.H2O2
D.MgCl2
参考答案:B
本题解析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,如果是同一种非金属原子之间形成共价键,则是非极性键,而由不同种非金属元素的原子之间形成的共价键,则是极性键。含有离子键的化合物是离子化合物,据此可知,选项B符合。A是含有非极性键的单质,C是含有极性键和非极性键的共价化合物,D是只有离子键的离子化合物,答案选B。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题主要是考查学生对化学键概念,以及化学键与化合物关系的熟悉了解程度,有利于培养学生的逻辑推理能力,有助于巩固学生的基础知识,提高学生的应试能力。
本题难度:简单
3、选择题 短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
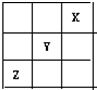
A.Z一定是活泼的金属元素
B.Y的最高价氧化物的水化物是一种强酸
C.Y一定是非金属性很强的元素
D.1molX的单质跟足量水反应时,发生转移的电子为2mol
参考答案:由短周期元素在周期表中的位置可知,X最外层电子数为2,应为He元素,Y为F元素,Z为S元素,
A、Z为S元素,属于非金属元素,故A错误;
B、Y为F元素,无正价,没有对应的含氧酸,故B错误;
C、Y为F元素,在周期表中是非金属性最强的元素,故C正确;
D、X为He元素,性质稳定,不与水反应,故D错误.
故选C.
本题解析:
本题难度:一般
4、填空题 【化学—选:3:物质结构与性质】(15分)
 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如右图。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如右图。
 请回答:
请回答:
 ?(1)A元素的名称是?;
?(1)A元素的名称是?;
 ?(2)B元素原子核外运动状态不同的电子数为?,C元素原子价电子层的电子排布图为?,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是?
?(2)B元素原子核外运动状态不同的电子数为?,C元素原子价电子层的电子排布图为?,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是?
 ?(3)元素E在周期表中的位置是?,它的+2价离子的电子排布式为?:
?(3)元素E在周期表中的位置是?,它的+2价离子的电子排布式为?:
(4)由以上五种元素的任意两种形成的常见化合物中,所含离子键成分最多的可能为?
 ?(5) 如图所示,D跟B形成的离子化合物晶体的密度为ag·cm-3,则晶胞的体积是
?(5) 如图所示,D跟B形成的离子化合物晶体的密度为ag·cm-3,则晶胞的体积是
?(只要求列出算式)。
参考答案:(1)氢? (1分)
(2)9 (2分)?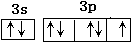 ?(2分)?
?(2分)?
HF分子间存在氢键,HCl分子间没有氢键(2分)
(3)第四周期第ⅦB族(2分)? 1s22s22p63s23p63d5或[Ar]3d5 (2分)
(4)CaF2? (2分)?(5)V =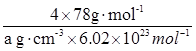 ? (2分)
? (2分)
本题解析:根据元素的结构及有关性质可知,A、B、C、D和E分别是H、F、Cl、Ca、Mn。
(1)A是氢元素。
(2)F的核外电子数是9,所以就要9种不同的运动状态。氯元素的价电子是7,所以电子排布图为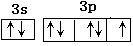 。HF分子间存在氢键,HCl分子间没有氢键,所以前者的
。HF分子间存在氢键,HCl分子间没有氢键,所以前者的
沸点高于后者。
(3)锰的原子序数是25,位于第四周期第ⅦB族。根据构造原理可知,其+2价离子的电子排布式为1s22s22p63s23p63d5或[Ar]3d5。
(4)金属性和非金属性越强,形成的化学键的离子成分就越多,五种元素中钙的顺序最强,F的非金属性最强,所以离子键成分最多的是CaF2。
(5)根据晶胞的结构可知,含有的钙离子是8×1/8+6×1/2=4,8个氟离子全部在晶胞内部,即该晶胞中含有4个CaF2,因此有 ,解得
,解得
V=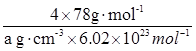
本题难度:一般
5、选择题 有关化学用语正确的是( )
①羟基的电子式?
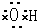
?②乙烯的结构简式:CH2CH2]③硫化氢的电子式
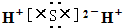
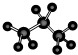
?④丙烷分子的球棍模型:
⑤苯分子的比例模型?

?⑥甲烷的结构式?
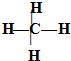
A.①④
B.②③④
C.④⑤⑥
D.②③⑤
参考答案:C
本题解析:
本题难度:简单