微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 原子核里一定没有的粒子是?(?)
A.电子
B.质子
C.中子
D.质子和中子
参考答案:A
本题解析:略
本题难度:简单
2、选择题 下列叙述能说明氯元素原子得电子能力比硫元素强的是:
①HCl的溶解度比H2S大?②HCl的酸性比H2S强?③HCl的稳定性比H2S强?
④HCl的还原性比H2S强?⑤HClO的酸性比H2SO4弱?
⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS?⑦Cl2能与H2S反应生成S
⑧在周期表中Cl处于S同周期的右侧?⑨还原性:Cl-<S2-
A.③④⑤⑦⑧⑨
B.③⑥⑦⑧
C.③⑥⑦⑧⑨
D.①②③④⑤⑥⑦⑧⑨
参考答案:C
本题解析:考查元素非金属性强弱比较。非金属性的比较规律:
1、由元素原子的氧化性判断:一般情况下,氧化性越强,对应非金属性越强。
2、由单质和酸或者和水的反应程度判断:反应越剧烈,非金属性越强。
3、由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强。
4、由和氢气化合的难易程度判断:化合越容易,非金属性越强。
5、由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强。(除氟元素之外)
6、由对应阴离子的还原性判断:还原性越强,对应非金属性越弱。
7、由置换反应判断:强置弱。〔若依据置换反应来说明元素的非金属性强弱,则非金属单质应做氧化剂,非金属单质做还原剂的置换反应不能作为比较非金属性强弱的依据〕
值得注意的是:氟元素没有正价态,故没有氟的含氧酸,所以最高价氧化物对应水合物的酸性最强的是高氯酸,而不是非金属性高于氯的氟元素!故规律5只适用于氟元素之外的非金属元素。
8、按元素周期律,同周期元素由左到右,随核电荷数的增加,非金属性增强;同主族元素由上到下,随核电荷数的增加,非金属性减弱。
所以正确的答案是C。
本题难度:一般
3、选择题 现有三组溶液(1)汽油和氯化钠溶液;(2)酒精和水的混合溶液;(3)氯化钠和单质溴的溶液.以上混合溶液分离的正确方法依次是
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
参考答案:C
本题解析:
本题难度:困难
4、填空题 (10分)下表中的实线表示元素周期表的部分边界。①-⑥分别表示元素周期表中对应位置的元素。
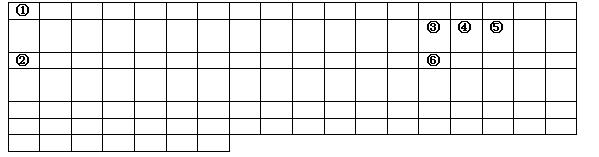
(1 )请在上表中用实线补全元素周期表边界。
)请在上表中用实线补全元素周期表边界。
(2)写出①、③两种元素组成的正四面体化合物的电子式?上述元素中,上述元素中能和⑤号元素形成正四面体空间网状结构的化合物的化学式是??
(3)上述元素中的一种元素其气态氢化物和该元素的最高价氧化物的水化物能发生化合反应,该反应的化学反应方程式为____________________________________________________
该物质含有的化学键是?。
参考答案:(每空各2分)
(1)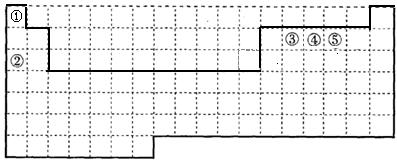 ?(2)
?(2)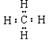 ;SiO2?
;SiO2?
?(3)NH3 +HNO3=NH4NO3;?离子键、共价键
本题解析:略
本题难度:一般
5、选择题 下列各组混合物,适合用分液方法分离的是
A.食盐和泥沙
B.食盐和水
C.酒精和水
D.汽油和水
参考答案:D
本题解析:分析:分液可以将互不相溶的两层液体分开.
解答:A.食盐和泥沙应先溶解后用过滤分离,故A错误;
B.食盐和水是互溶的,可以利用蒸发来分离,故B错误;
C.酒精和水是互溶的,可以利用蒸馏来分离,故C错误;
D.汽油和水是互不相溶的两层液体,可以用分液分离,故D正确.
故选D.
点评:本题考查学生物质分离方法中的分液法,熟记教材知识是解题的关键所在,难度不大.
本题难度:一般