微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (1)配位化学创始人维尔纳发现,取COCl3?6NH3?(黄色)、CoCl3?5NH3(紫红色)、COCl3?4NH3(绿色)和COCl3?4NH3(紫色)四种化合物各1mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3mol、2mol、1mol和1mol.
①请根据实验事实用配合物的形式写出它们的化学式.
COCl3?6NH3______,COCl3?5NH3______,COCl3?4NH3(绿色和紫色)______.
②后两种物质组成相同而颜色不同的原因是______.
③上述配合物中,中心离子的配位数都是______.
(2)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成血红色.该反应在有的教材中用方程式FeCl3+3KSCN═Fe(SCN)3+3KCl表示.经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合.请按要求填空:
①Fe3+与SCN-反应时,Fe3+提供______,SCN-提供______,二者通过配位键结合.
②所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色.含该离子的配合物的化学式是______.
③若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl
.
参考答案:(1)①1molCoCl3?6NH3只生成3molAgCl,则1molCoCl3?6NH3中有3molCl-为外界离子,钴的配位数为6,则配体为NH3和Cl-,所以其化学式为[Co(NH3)6]Cl3;
1molCoCl3?5NH3只生成2molAgCl,则1molCoCl3?5NH3中有2molCl-为外界离子,钴的配位数为6,则配体为NH3和Cl-,所以其化学式为[Co(NH3)5(Cl)]Cl2;
1molCOCl3?4NH3(绿色)和CoCl3?4NH3(紫色)只生成1molAgCl,则1molCoCl3?4NH3中有1molCl-为外界离子,钴的配位数为6,则配体为NH3和Cl-,所以其化学式为[Co(NH3)4(Cl)2]Cl,
故答案为:[Co(NH3)6]Cl3,[Co(NH3)5(Cl)]Cl2,[Co(NH3)4(Cl)2]Cl,[Co(NH3)4(Cl)2]Cl;
②CoCl3?4NH3(绿色)和CoCl3?4NH3(紫色)的化学式都是[Co(NH3)4(Cl)2]Cl,但因其空间构型不同导致颜色不同
故答案为:空间构型不同;
③这几种配合物的化学式分别是[Co(NH3)6]Cl3、[Co(NH3)5(Cl)]Cl2、[Co(NH3)4(Cl)2]Cl,其配位数都是6,
故答案为:6;
(2)①Fe3+与SCN-反应生成的配合物中,Fe3+提供空轨道,SCN-提供孤对电子,故答案为:空轨道,孤对电子;
②Fe3+与SCN-以个数比1:1配合所得离子为[Fe(SCN)]2+,故FeCl3与KSCN在水溶液中反应生成[Fe(SCN)]Cl2与KCl,
故答案为:[Fe(SCN)]Cl2;
③Fe3+与SCN-以个数比1:5配合所得离子为[Fe(SCN)5]2-,故FeCl3与KSCN在水溶液中反应生成K2[Fe(SCN)5]2-与KCl,所以反应方程式为:FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl,
故答案为:FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.
本题解析:
本题难度:一般
2、填空题 Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
| 元素 | Mn | Fe
|
电离能/kJ?mol-1
I1
717
759
I2
1509
1561
I3
3248
2957
|
回答下列问题:
(1)Mn元素价电子层的电子排布式为______,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是______.
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是______.
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为______晶体.
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为______,其中体心立方晶胞空间利用率为______.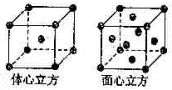
参考答案:(1)Mn元素为25号元素,核外电子排布式为[Ar]3d54s2,所以价层电子排布式为3d54s2,
由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(2)Fe原子或离子含有空轨道.所以,与Fe原子或离子形成配合物的分子或离子应具有孤对电子,故答案为:具有孤对电子;
(3)三氯化铁,其熔点:282℃,沸点315℃,在300℃以上升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.符号分子晶体的特征,故为三氯化铁分子晶体,
故答案为:分子;
(4)面心立方结构晶胞中铁原子数为1+6×12=4;体心立方结构晶胞中铁原子数为1+8×18=2,属于两种结构的铁原子数之比为4:2=2:1,体心立方晶胞空间利用率为68%,
故答案为:2:1;68%.
本题解析:
本题难度:一般
3、填空题 Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的分子式分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br,在第一种配合物的溶液中加BaCl2溶液时,________________现象;如果在第二种配合物的溶液中加入BaCl2溶液时,________现象,若加入AgNO3溶液时,产生
_______________现象。
参考答案:白色沉淀;无异常;淡黄色沉淀
本题解析:
本题难度:一般
4、填空题 完成下列各小题︰
(1)在CuSO4溶液中滴入少量稀氨水,现象是:___________________,反应的离子方程式为__________________________________________________;继续滴入过量稀氨水,发现难溶物溶解并生成深蓝色溶液,测得该溶液中的主要离子是[Cu(NH3)4(H2O) 2]2+,已知该配离子空间构型呈八面体形,则铜离子的杂化方式为______________,配体有______________种,配体分子的空间构型依次是______________;______________。
(2)写出27Co3+离子的价电子排布式______________,已知钴27Co3+的配位数为6,有一种组成为Co(NH3)5Cl3的配合物,取此配合物1mol与足量AgNO3溶液反应仅能析出2molAgCl沉淀,则该配合物的化学式为:_______________。
参考答案:(1)出现淡蓝色沉淀;Cu2+ + 2NH3·H2O = Cu(OH)2↓+ 2NH4+ ;sp3d2 ;2;V形(或角形);三角锥形
(2) 3d6;[Co(NH3)5Cl]Cl2
本题解析:
本题难度:一般
5、填空题 (1)请根据[Zn(NH3)4]2+中配 位键的形成,总结配位键形成的条件。
____________________
(2)在Fe3+、Cu2+、Zn2+、Ag+、H2O、NH3、F-、CN-、CO中,哪些可以作为中心原子?哪些可以作为配位体?中心原子:____________。配位体:_____________。
(3)现有两种配合物晶体[Co(NH3)6]Cl3和[Co(NH3)5Cl]Cl2,一种为橙黄色,另一种为紫红色。请设计实验方案将这两种配合物区别开来。实验方案: ____________。
参考答案:(1)形成配位键的条件是其中一个原子有孤对电子,另一个原子有接受孤对电子的空轨道
(2)Fe3+、Cu2+、Zn2+、Ag+;H2O、NH3、F-、CN-、CO
(3)称取相同质量的两种晶体分别配成溶液,向两种溶液中分别滴加足量的AgNO3溶液,静置、过滤、干燥、称量,所得AgCl固体多的原晶体为[Co(NH3)6]Cl3,另一种则为
[Co(NH3)5Cl]Cl2
本题解析:
本题难度:一般