微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
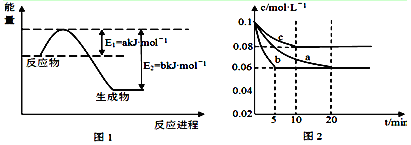
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(a、b均大 于0),且已知: 2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-c kJ·mol-1(c>0),请写出CO将NO2还原至N2时的热化学方程式 ;
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1, c(H2)=0.3mol·L-1;
合成氨的反应:N2(g)+3H2(g) 2NH3(g) △H< 0
2NH3(g) △H< 0
①计算在a达平衡时H2的转化率为 ;
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是 ; 试写出判断b与a条件不同的理由 ;
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如 下表:
T/(K)
| 298
| 398
| 498
| ……
|
K
| 4.1×106
| K1
| K2
| ……
|
①试确定K1的相对大小,K 1 4.1× 106(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内NH3的浓度保持不变 B.2υ( N2)正= υ( H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示 ) 。
②25℃时,将pH =x氨水与pH =y的硫酸(且x + y =" 14," x > 11 )等体积混合后,所得溶液中各种离子的浓度关系正确的是
A.c(SO42-)>c(NH4+)>c(H+)>c(OH-) B.c(NH4+)>c(SO42-)>c(OH-)>c(H+)
C.c(NH4+)+c(H+)>c(SO42-)+c(OH-) D.c(NH4+)>c(SO42-)>c(H+)>c(OH-)
参考答案:(14分)
(1) 4CO(g)+2NO2(g)=4CO2(g)+N2(g) △H=-(2b+c-2a)kJ·mol-1(2分)
(或 4CO(g)+2NO2(g)=4CO2(g)+N2(g) △H=(2a-2b-c)kJ·mol-1等)
(2)①40%(2分)
②升高温度(1分);因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以b、a两条件下达到平衡时N2的浓度相同(或其他合理答案)(2分)
(3)<(1分);AC(2分)
(4)①NH4++H2O NH3·H2O+H+(2分)
NH3·H2O+H+(2分)
②BC(2分)
本题解析:(1)由图1可知,1mol NO2和1mol CO反应生成CO2和NO的热化学方程式是CO(g)+NO2(g)=CO2(g)+NO(g) △H=-(b-a)kJ/mol,根据盖斯定律,将2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-c kJ·mol-1与上式×2相加,可得CO将NO2还原至N2时的热化学方程式,为4CO(g)+2NO2(g)=4CO2(g)+N2(g) △H=-(2b+c-2a)kJ·mol-1;
(2)①在a达平衡时,氮气的浓度减小(0.1-0.06)mol/L=0.04mol/L,则氢气的浓度减小0.04mol/L×3=0.12mol/L,则平衡时 H2的转化率为0.12mol/L/0.3mol/L×100%=40%;
②由图2可知,曲线c达平衡时氮气的浓度增大且达平衡的时间缩短,说明反应速 率加快,且平衡逆向移动,因为合成氨是放热反应,所以c改变的条件可能是升高温度,升高温度,平衡逆向移动,反应速率加快;而b达平衡时与a的氮气的浓度相同,达平衡的时间缩短,反应速率加快,说明平衡不移动,则b改变的条件是加入催化剂,所以b与a的条件不同;
(3)①合成氨是放热反应,温度升高,平衡逆向移动,平衡常数减小,所以K1<4.1× 106;
②A、达平衡时,各物质的浓度均保持不变,所以容器内NH3的浓度保持不变的状态是平衡状态,正确;B、根据化学方程式可知,达平衡时,3υ( N2)正= υ( H2)逆,错误;C、因为合成氨的反应是气体的物质的量发生改变的可逆反应,所以容器的体积固定时,压强不变的状态是平衡状态,正确;D、因为容器的体积不变,气体的总质量不变,所以气体的密度一直不变,所以气体的密度不变的状态不是平衡状态,错误,答案选AC;
(4)①NH4Cl溶液呈酸性的原因是因为铵根离子发生水解反应,使溶液中的氢离子浓度大于氢氧根离子的浓度,离子方程式是NH4++H2O NH3·H2O+H+;
NH3·H2O+H+;
②25℃时,将pH =x氨水与pH =y的硫酸(且x + y =" 14," x > 11 )等体积混合后,则氨水溶液中的氢氧根
离子浓度等于硫酸中的氢离子浓度,因为氨水是弱碱溶液,所以等体积混合后,一水合氨过量,溶液
呈碱性,排除BD,得到的溶液为硫酸铵和一水合氨的混合液,则溶液中c(NH4+)>c(SO42-)>c(OH-)>c(H
+)成立;根据电荷守恒规律,有c(NH4+)+c(H+)=2c(SO42-)+c(OH-),c(SO42-)>0,所以c(NH4+)+c(H
+)>c(SO42-)+c(OH-),则答案选BC。
考点:考查盖斯定律的应用,热化学方程式的书写,溶液中离子浓度的判断,化学平衡移动的判断
本题难度:困难
2、选择题 下列有关溶液中微粒的物质的量浓度的关系,正确的是
A.0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合的溶液:c(Cl-)>c(Na+)>c(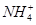 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(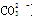 )
)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
D.某二元弱酸的酸式盐NaHA溶液:c(OH-)+c(H2A)=c(H+)+2c(A2-)
参考答案:B
本题解析:A、0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合的溶液,得到等浓度的氯化铵、一水合氨、氯化钠的混合液,溶液呈碱性,所以溶液中的离子浓度的大小关系是c(Cl-)> >c(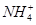 )>c(Na+)>c(OH-)>c(H+),错误;B、等物质的量的NaClO、NaHCO3混合溶液中,根据物料守恒,可得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(
)>c(Na+)>c(OH-)>c(H+),错误;B、等物质的量的NaClO、NaHCO3混合溶液中,根据物料守恒,可得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(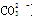 ),正确;C、因为酸、碱的强弱未知,所以混合后溶液的酸碱性不能确定,错误;D、根据质子守恒,应有c(OH-)=c(H+)-c(A2-)+ c(H2A),则c(OH-)+c(A2-)=c(H+)+c(H2A),错误,答案选B。
),正确;C、因为酸、碱的强弱未知,所以混合后溶液的酸碱性不能确定,错误;D、根据质子守恒,应有c(OH-)=c(H+)-c(A2-)+ c(H2A),则c(OH-)+c(A2-)=c(H+)+c(H2A),错误,答案选B。
考点:考查溶液混合的计算,离子浓度的比较,守恒规律的应用
本题难度:困难
3、选择题 下列离子方程式中,属于水解反应的是
[? ]
A.HCOOH+H2O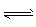 HCOO-+H3O+
HCOO-+H3O+
B.CO2+H2O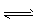 HCO3-+H+
HCO3-+H+
C.CO32-+H2O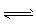 HCO3-+OH-
HCO3-+OH-
D.HS-+H2O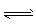 S2-+H3O+
S2-+H3O+
参考答案:C
本题解析:
本题难度:简单
4、选择题 物质的量浓度相同的下列溶液中, NH4+浓度最大的是
A.NH4Cl
B.CH3COONH4
C.NH4HSO4
D.NH4HCO3