微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)铝及其化合物用途广泛
(1)铝元素的离子结构示意图为
(2)下列实验能说明Al的金属性(原子失电子能力)小于Na的是 (填序号)。
a.分别将Na和Al同时放人冷水中
b.测定等物质的量的Na和A1与酸反应生成H2的体积
c.向Al(OH)3悬浊液中加人足量NaOH溶液
d.用pH计测量NaCl溶液与AlC13溶液的pH
(3)工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,每生产1吨Al,阳极大约会损失0.6吨的石墨,则石墨被氧化为 (填化学式)。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为____
(5)室温下,往0.2 mol·L-1 Al2 ( SO4)3溶液中逐滴加人1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化的曲线如图所示
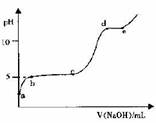
①a点溶液呈酸性的原因是(用离子方程式表示)_______
②c→d时,A1元素的主要存在形式是 (填化学式)
③根据图中数据计算,A1(OH)3的KSP ≈ 。
参考答案:(1)  (2)a、c、d (3)CO、CO2
(2)a、c、d (3)CO、CO2
(4)2Al2O3(s)+6C(s)=Al4C3(s)+3CO2 (g) △H="+12" akJ·mol-1
(5)①Al3++3H2O Al(OH)3 +3H+ ②Al(OH)3 ③4×10-28
Al(OH)3 +3H+ ②Al(OH)3 ③4×10-28
本题解析:(1)铝是13号元素,最外层有3个电子,在化学反应中失去3个电子形成铝离子,铝离子的原子结构示意图是
(2) 元素金属性强弱判断依据为看金属与酸或水反应的剧烈程度,反应速率越快,越剧烈,金属性越强,a.分别将Na和Al同时放人冷水中,钠与水剧烈反应,铝几乎不反应,说明钠的金属性强于铝,正确;b.测定等物质的量的Na和A1与酸反应生成H2的体积,与钠、铝失电子数有关,与金属性强弱无关,错误;Al(OH)3能溶于NaOH,说明Al(OH)3是弱碱,NaOH是强碱,所以钠的金属性强于铝,正确;d.用pH计测量NaCl溶液与AlC13溶液的pH,NaCl溶液的PH=7,是强酸强碱盐,AlCl3溶液的PH<7属于强酸弱碱盐,说明Na的金属性强于铝,正确;选a、c、d。
(3)根据化学反应2Al2O3 4Al+3O2,每生产1吨Al,阳极产生8/9吨氧气,若只生成CO,2C + O2 = 2CO大约会损失石墨=(24×8/9)÷32=2/3吨,若只生成CO2 ,C + O2 = CO2,大约会损失石墨=(12×8/9)÷32=1/3吨,实际上损失0.6吨的石墨,所以石墨被氧化为CO和CO2。
4Al+3O2,每生产1吨Al,阳极产生8/9吨氧气,若只生成CO,2C + O2 = 2CO大约会损失石墨=(24×8/9)÷32=2/3吨,若只生成CO2 ,C + O2 = CO2,大约会损失石墨=(12×8/9)÷32=1/3吨,实际上损失0.6吨的石墨,所以石墨被氧化为CO和CO2。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2,化学方程式为2Al2O3+6C=Al4C3+3CO2,转移电子12e-,已知该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为2Al2O3(s)+6C(s)=Al4C3(s)+3CO2 (g) △H="+12" akJ·mol-1。
(5)①a点是硫酸铝溶液,属于强酸弱碱盐,铝离子水解导致溶液呈酸性,用离子方程式表示为Al3++3H2O Al(OH)3 +3H+,
Al(OH)3 +3H+,
②在c→d段pH逐渐增大,说明沉淀逐渐溶解,到达d点,Al(OH)3沉淀已完全溶解,所以c→d时,A1元素的主要存在形式是Al(OH)3。
③向硫酸铝溶液中加入NaOH,当PH=5时开始出现Al(OH)3沉淀,说明此时建立了沉淀溶液平衡,OH-的浓度为10-9mol/L假如,铝离子浓度不变,为0.4mol/L,则A1(OH)3的KSP ≈0.4×[10(-9)]3=4×10-28。
考点:考查铝及其化合物的性质。
本题难度:困难
2、选择题 在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
A.25 ℃时,CuS的溶解度大于ZnS的溶解度
B.25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
参考答案:D
本题解析:对于组成相似的难溶解电解质,Ksp越大,其溶解性越大,CuS的溶解小于ZnS,A错;饱和CuS溶液中,Cu2+的浓度是Ksp1/2=(1.3×10-36)1/2,B错;相同条件下,加入S2-离子,Ksp小的先沉淀,所以Zn2+先沉淀,C错;加入FeS,可以转化为Ksp小的CuS,D正确。答案选D。
本题难度:一般
3、选择题 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O===Cu(OH)2↓+CO2↑
次要:Cu2++CO32-===CuCO3↓
(2)CuSO4+Na2S
主要:Cu2++S2-===CuS↓
次要:Cu2++S2-+2H2O===Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是
[? ]
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
参考答案:A
本题解析:
本题难度:一般
4、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是
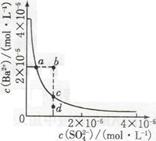
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.b点有BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
参考答案:C
本题解析:A、a点表示某一温度的BaSO4的饱和溶液,加入Na2SO4后溶解平衡逆向移动,Ba2+浓度减小,错误;B、蒸发溶剂会使SO4、Ba2+浓度均增大,错误;C、b点时的离子积QC大于溶度积,所以会有BaSO4沉淀析出,正确;D、Ksp是温度常数,只与温度有关,所以a点与c点的Ksp相等,错误,答案选C。
本题难度:一般
5、选择题 下列关于难溶电解质溶液说法正确的是 (? )
A.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
B.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl-
D.25 ℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体后,c(Mg2+)增大
参考答案:C D
本题解析:A、在含有BaSO4沉淀的溶液中存在沉淀溶解平衡,溶度积一定温度下是常数,加入Na2SO4固体后硫酸根离子浓度增大,平衡逆向进行,钡离子浓度减小,故A错误;
B、相同温度下,氯化银在水溶液中存在沉淀溶解平衡,依据溶度积是常数,与①蒸馏水相比较,②中0.1 mol·L-1盐酸溶液中氯离子0.1mol·L-1,抑制沉淀溶解平衡,银离子浓度减小;③中0.1 mol·L-1氯化镁溶液中氯离子浓度为0.2mol·L-1,平衡逆向进行,银离子浓度减小;④中0.1 mol?L-1硝酸银溶液中,银离子浓度为0.1mol·L-1,平衡逆向进行,银离子浓度增大,则Ag+浓度:④>①>②>③,故B错误;
C、硫化银溶解度小于氯化银,可以实现沉淀转化,则向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl-,故C正确;
D、氢氧化镁溶液中存在沉淀溶解平衡,氯化铵水解显酸性,与氢氧根离子结合,促进平衡向溶解方向进行,所以镁离子浓度增大,故D正确;
故选CD.
本题难度:一般