微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下列有关化学实验正确的是______(填序号).
①用点燃的方法除去CO2中的CO;
②除去乙酸乙酯中少量乙酸,可用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏;
③用碱式滴定管量取20.00mL0.1000mol?L-1KMnO4溶液;
④配制100mL1.00mol?L-1的NaCl溶液时,可用托盘天平称取5.85gNaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,应立即用酒精清洗;
⑥用瓷坩埚高温熔融Na2CO3;
⑦物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行;
⑧浓硫酸、浓硝酸等强氧化性酸保存在带磨口玻璃塞的试剂瓶中.
参考答案:①点燃时会引入氧气,不符合除杂的原则,应利用混合物通过CuO加热来除杂,故错误;
②碳酸钠与乙酸反应,且降低乙酸乙酯的溶解度,则反应后洗涤、分液、干燥、蒸馏,故正确;
③高锰酸钾能氧化碱式滴定管中的橡胶管,应选用酸式滴定管,故错误;
④托盘天平只能准确到0.1g,不能称取5.85gNaCl固体,故错误;
⑤苯酚易溶于酒精,则不慎将苯酚溶液沾到皮肤上,应立即用酒精清洗,故正确;
⑥瓷坩埚中二氧化硅与碳酸钠反应,则应利用铁坩埚高温熔融Na2CO3,故错误;
⑦量筒只能在常温下使用,不能作溶解或反应容器,则物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行,故正确;
⑧浓硫酸、浓硝酸等强氧化性酸等不与玻璃反应,可保存在带磨口玻璃塞的试剂瓶中,故正确;
故答案为:②⑤⑦⑧.
本题解析:
本题难度:一般
2、填空题
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是____________________;X 与过量浓硝酸反应后溶液中含有的盐的化学式为_______________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是
_____________;
A. Mg2+ B. Fe2+ C. Al3+ D. Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
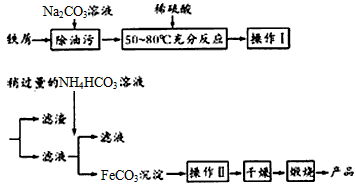
回答下列问题:
①操作I的名称是_______,操作II的名称是________;操作Ⅱ的方法为_____________
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)____________________;
③请完成生成FeCO3沉淀的离子方程式__________________
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+ = 5Fe3++Mn2+ +4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________________。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是_________
A.稀硝酸 B.稀盐酸 C.稀硫酸 D.浓硝酸
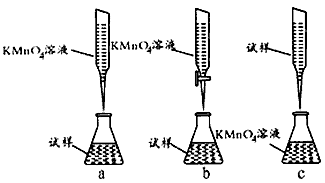
③某同学设计的下列滴定方式,最合理的是_______。 (夹持部分略去)(填字母序号)
参考答案:(1)Fe2+、Fe3+、H+;Fe(NO3)3
(2)BC
(3)①过滤;洗涤;在漏斗中加入适量蒸馏水,浸没过沉淀,让蒸馏水自然流下,重复数次
②CO32- + H2O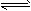 HCO3-+OH-;③Fe2++2HCO3- = FeCO3↓+CO2↑+H2O
HCO3-+OH-;③Fe2++2HCO3- = FeCO3↓+CO2↑+H2O
(4)①250mL容量瓶;②C;③b
本题解析:
本题难度:困难
3、选择题 某学生的实验报告所列出的下列数据中合理的是
[? ]
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
参考答案:D
本题解析:
本题难度:简单
4、填空题 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成
CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol/L的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________________________。
(2)判断滴定终点的方法是________________________。
(3)计算:血液中含钙离子的浓度为________g·mL-1。
参考答案:(1)2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
(2)当滴入1滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不退色
(3)1.0×10-4
本题解析:
本题难度:一般
5、选择题 下列有关实验原理,方法和结论都正确的是( )
A.某钠盐溶液中加入硝酸无明显现象,再加入氯化钡溶液有白色沉淀,该钠盐一定是硫酸钠
B.在硫酸钡中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)
C.新制氯水中加入碳酸钙粉末搅拌,过滤、滤液中c(HClO)将增大
D.相同质量的两份锌粒分别加入足量稀硫酸,在一份中加入少量CuSO4?5H2O,其反应速率将加快,且最终产生的H2与另一份相同
参考答案:C
本题解析:
本题难度:一般