微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把500mL含有氯化钡和氯化钾的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀,另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀,则该混合溶液中钾禽子浓度为(? )
A.10(b-2a)mol/L
B.10 (b-a)mol/L
C.10(2a-a)mol/L
D.0.1(b-2a)mol/L
参考答案:A
本题解析:SO42-?+? Ba2+?=? BaSO4↓;Cl-?+? Ag+?=? AgCl↓
a mol? 来源:91考试网 91eXAm.orga mol? bmol? bmol
则表明每一份中含有的钾离子的物质的量为:n(K+)=(b-2a)mol
则该混合溶液中钾离子的物质的量为:5 n(K+) =5(b-2a)mol
则该混合溶液中钾离子浓度为:
本题难度:一般
2、实验题 为验证Cl2、Br2的氧化性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如下图,填写图中的空白。

(1)2 mL 试剂 ;加入少量 试剂;再加入
试剂; 现象: 。
(2)可以证明Cl2的氧化性____________(填“强于”或“弱于”)Br2的氧化性;氯元素的非金属性 ____________(填“强于”或“弱于”)_溴元素的非金属性。
( 3 )此反应的离子方程式为:________________________________________。
(4)某溶液中Cl-、Br-、I-的物质的量之比为4∶1∶4,要使溶液中的Cl-、Br-、I-的物质的量之比变为7∶1∶1,则通入Cl2的物质的量与原溶液中I-的物质的量之比为______。
参考答案:(1)NaBr溶液 ; 氯水 ; 四氯化碳 ; 分成两层 上层无色、下层棕红色(或橙色或橙红色) 。
(2)强于;强于(3)Cl2+2Br-=2Cl-+Br2
(4)3:8
本题解析:(1)验证Cl2、Br2的氧化性强弱,结合题干提供的试剂,可知第一支试管应该装的是2mLNaBr溶液,第二支试管中加入氯水,振荡之后再加入CCl4把置换出来的Br2从混合液中萃取出来,混合液分成两层,上层为NaCl溶液无色,下层Br2和CCl4,呈棕红色(或橙色或橙红色)。
(2)由实验证明Cl2的氧化性强于Br2的氧化性,结合元素周期律,也可得氯元素的非金属性强于溴元素的非金属性。该反应的离子方程式为:Cl2+2Br-=2Cl-+Br2 。
(4)依题意,可设原溶液中Cl-、Br-、I-的物质的量为4X、X、4X,反应后溶液中的Cl-、Br-、I-的物质的量为7X、X、X,通入氯气后,发生如下反应:Cl2+2I-=2Cl-+I2,可知I-的减少量为Cl2通入量的2倍,则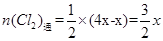 ,
, 。
。
考点:化学实验,卤素的化学性质,物质的量计算。
点评:探究式实验是近年来高考的热点,重在培养学生的发散性思维,逻辑思维能力,本题难度不大,解题的关键是要掌握卤素的化学性质和反应方程式的正确书写,结合反应原理,题干信息,巧妙假设,化繁为简。
本题难度:困难
3、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是
A.25℃时,pH=13的氨水中含有OH-的数目为0.1NA
B.标准状况下,2.24 LNO2与水反应生成NO3-的数目为0.1NA
C.1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA
D.4.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA
参考答案:C
本题解析:
试题分析:A、25℃时,pH=13的氨水中OH-的浓度是0.1mol/L,但不能确定溶液的体积,因此不能计算OH-的数目,A不正确;B、标准状况下,2.24 LNO2的物质的量=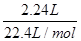 =0.1mol。NO2与水反应的方程式为3NO2+H2O =2HNO3+NO,在反应中氮元素的化合价从+4价部分升高到+5价,部分降低到+2价,因此0.1molNO参加反应转移电子的物质的量是
=0.1mol。NO2与水反应的方程式为3NO2+H2O =2HNO3+NO,在反应中氮元素的化合价从+4价部分升高到+5价,部分降低到+2价,因此0.1molNO参加反应转移电子的物质的量是 ×0.1mol,B不正确;C、钠在反应中只能失去1个电子,因此1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA,C正确;D、4.0g氢气的物质的量=4g÷2g/mol=2mol,与氧气反应消耗1mol。氢气含有1个单键,氧气含有1个双键因此共断裂共价键的总数=(2+1)NA=3NA,D不正确,答案选C。
×0.1mol,B不正确;C、钠在反应中只能失去1个电子,因此1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA,C正确;D、4.0g氢气的物质的量=4g÷2g/mol=2mol,与氧气反应消耗1mol。氢气含有1个单键,氧气含有1个双键因此共断裂共价键的总数=(2+1)NA=3NA,D不正确,答案选C。
本题难度:一般
4、选择题 下列溶液中的C(Cl-)?与50mL1mol/L?AlCl3溶液中的C(Cl-)?相等的是( )
A.150mL3mol/LKCl溶液
B.75mL2mol/LNH4Cl溶液
C.150mL1mol/LNaCl溶液
D.75mL1.5mol/LFeCl3溶液
参考答案:50mL1mol/L?AlCl3溶液中Cl-的物质的量浓度为3mol/L.
A、3mol/LKCl溶液中氯离子的浓度为3mol/L,故A正确;
B、2mol/LNH4Cl溶液溶液中氯离子的浓度为2mol/L×1=2mol/L,故B错误;
C、1mol/LNaCl溶液中氯离子的浓度为1mol/L,故C错误;
D、1.5mol/LFeCl3溶液中所含Cl-的物质的量浓度为1.5mol/L×3=4.5mol/L,故D错误.
故选:A.
本题解析:
本题难度:一般
5、选择题 阿伏加德罗常数为NA,下列说法正确的是
A.1 mol 硫酸钾中阴离子所带电荷数为NA
B.乙烯和环丙烷以任意比混合气体28 g,含有4 NA个氢原子
C.将0.1 mol氯化铁溶于1 L水中,所得溶液含Fe3+数为0.1 NA
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA
参考答案:B
本题解析:A、一个硫酸根离子带两个电荷,1 mol 硫酸钾中阴离子所带电荷数为2NA,错误;B、乙烯和环丙烷最简式都是CH2(14),28除以14等于2,相当于2mol CH2,正确;C、铁离子水解,溶液含Fe3+小于0.1NA,错误;D、Cl2 + 2NaOH ="=" NaClO + NaCl + H2O,转移的电子数为1NA
本题难度:一般