微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x值.通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该组同学设计了滴定的方法测定x值.
①称取1.260g纯草酸晶体,将其酸制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00mL;
请回答:
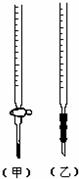
(1)滴定时,将KMnO4标准液装在右图中的______(填“甲”或“乙”)滴定管中.
(2)本实验滴定达到终点的标志是______.
(3)通过上述数据,计算出x=______.
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会______(填“偏大”、“偏小”或“不变”,下同).
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会______.
参考答案:(1)因为KMnO4具有强氧化性,会腐蚀橡胶管,故应用酸式滴定管盛装,故答案为:甲;
(2)可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KMnO4溶液时,溶液将由无色变为紫色,
故答案为:当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
(3)由题给化学方程式及数据可知,1.260g纯草酸晶体中含H2C2O4的物质的量为:0.100 0 mol/L×10.00 mL×10-3 L/mL×52×100 mL25 mL=0.0100 mol,
则1.260 g H2C2O4?xH2O中含H2O的物质的量为1.260 g-0.010 0 mol×90 g/mol18 g/mol=0.020 0 mol,则x=2.
若滴定终点时俯视滴定管读数,则所得消耗酸性KMnO4溶液的体积偏小,由此所得n(H2C2O4)偏小,则n(H2O)偏大,x偏大;
同理,若KMnO4溶液变质,则消耗其体积偏大,所得x值偏小,
故答案为:2;偏大;偏小.
本题解析:
本题难度:一般
2、选择题 下列几种情况对中和滴定结果无影响的是( )
A.盛待测液的锥形瓶里留有蒸馏水
B.滴定管尖嘴部分在滴定前有气泡
C.滴定管没有润洗
D.滴定达终点时,视线高于滴定管内液体的凹面的最低点
参考答案:A
本题解析:
本题难度:简单
3、实验题 用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1 000 mL溶液。除烧杯外,还需要的玻璃仪器有___________、_________、___________。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_______________式滴定管。
②滴定时双眼应____________。
③有关数据记录如下:

(3)计算纯度:烧碱样品的纯度是_________________。
(4)误差讨论(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果___________;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果___________;
③读数时,滴定前仰视,滴定后俯视,则会使测定结果___________。
参考答案:(1)1 000 mL容量瓶;玻璃棒;胶头滴管
(2)①酸?; ②注视锥形瓶中溶液颜色的变化
(3)80.8%
(4)①无影响 ;②偏高 ;③偏低
本题解析:
本题难度:一般
4、简答题 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻棒外,还需要用到的主要仪器有______,______;
(2)滴定过程:
①盛装0.10mol/L的盐酸标准液应该使用______滴定管;②滴定时双眼应注意观察______;
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,测定结果______;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果______;
③读数时,滴定前仰视,滴定后俯视,测定结果______;
④装标准液之前,没有用标准液润洗滴定管,测定结果______;
(4)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL)
滴定前读数
滴定后读数
1
20.00
0.50
20.78
2
20.00
1.20
21.32
|
计算纯度:烧碱样品的纯度是______(取两次实验所耗盐酸的平均值进行计算,不写计算过程)
参考答案:(1)完成中和滴定还差1000mL容量瓶和胶头滴管;
故答案为:1000mL容量瓶 胶头滴管;
(2)①盛装0.10mol/L的盐酸标准液应该使用酸式滴定管;?②滴定时双眼应注意观察锥形瓶内溶液颜色的变化;
故答案为:酸式;? 锥形瓶内溶液颜色的变化;
(3)①冲洗锥形瓶,不影响待测物的总物质的量,不会影响测定结果;②导致盐酸消耗增多,测定结果偏大;③读数时,滴定前仰视,滴定后俯视,盐酸体积变小
,结果偏小;④装标准液之前,没有用标准液润洗滴定管,标准液浓度减小,消耗的盐酸增多,测定结果偏高;
故答案为:①无影响?②偏高?③偏小?④偏高?
(4)两次消耗盐酸体积分别为:20.78ml-0.50ml=20.28ml、21.32-1.20=20.12;消耗盐酸的平均体积为20.20mL,原溶液n(NaOH)=50×n(HCl)=50×0.10 mol/L×20.20mL×10-3=0.101mol,所以烧碱的纯度为? 40×0.1015×100%=80.8%;
故答案为:80.8%.
本题解析:
本题难度:一般
5、选择题 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从下表中选出正确选项( )
| 锥形瓶中液体 | 滴定试管中液体 | 选用指示剂 | 选用滴定管
①
碱
酸
石蕊
(乙)
②
酸
碱
酚酞
(甲)
③
碱
酸
甲基橙
(甲)
④
酸
碱
酚酞
(乙)
|
A.①
B.②
C.③
D.④