微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)已知:
① N2 (g) + 2O2 (g) = 2NO2 (g) △H1 =" +" 67.7kJ/mol
②N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H2 = -534kJ/mol
③1/2H2 (g) + 1/2F2 (g) = HF (g) △H3 = -269kJ/mol
④H2 (g) + 1/2O2 (g) = H2O (g) △H4 = -242kJ/mol
⑤H2O(l)====H2O(g) △H5=+44kJ·mol-1
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出液态肼和足量H2O2反应的热化学方程式_______________________________。
(2)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(3)16 g气态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(4根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式______________ ______________________。
(5)有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式: 。
参考答案:(1)N2H4(l)+2 H2O2 (l) ="==" N2(g)+ 4 H2O (g) △H=" -" 641.625 kJ·mol-1
(2)优点是生成N2和H2O,对环境无污染
(3)放出的热量是311 kJ。
(4)2N2H4(g)+2 NO2 (g) ="==" 3N2(g)+4 H2O(g);△H=" -" 1135.7kJ·mol-1
(5)N2H4 (g) +2 F2 (g) = N2(g) +4HF (g) △H = -1126 kJ/mol
本题解析:(1)考查热化学方程式的书写。0.4mol液态肼燃烧放出256.65kJ的热量,则1mol燃烧放出的热量是256.65kJ×2.5=641.625 kJ,因此热化学方程式为N2H4(l)+2 H2O2 (l) ="==" N2(g)+ 4 H2O (g) △H=" -" 641.625 kJ·mol-1。
(2)根据燃烧产物水和氮气可知,生成物对环境没有污染。
(3)根据反应②可知16 g气态肼燃烧生成氮气和气态水时,放出的热量是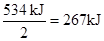 。生成物1mol气态水生成液态时,放出的热量是44kJ,所以16 g气态肼燃烧生成氮气和液态水时,放出的热量是267kJ+44kJ=311 kJ。
。生成物1mol气态水生成液态时,放出的热量是44kJ,所以16 g气态肼燃烧生成氮气和液态水时,放出的热量是267kJ+44kJ=311 kJ。
(4)②×2-①即得到2N2H4(g)+2 NO2 (g) ="==" 3N2(g)+4 H2O(g);△H=" -" 1135.7kJ·mol-1。
(5)根据盖斯定律可知③×4+②-④×2即得到N2H4 (g) +2 F2 (g) = N2(g) +4HF (g) △H = -1126 kJ/mol。
本题难度:一般
2、选择题 下列有关热化学方程式及其叙述正确的是
[? ]
A.氢气的燃烧热为285.5 kJ/mol,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g) △H=+285.5kJ/mol
B.1mol甲烷完全燃烧生成CO2和H2O(l)时放出890 kJ热量,它的热化学方程式为:1/2CH4(g)+O2(g)=
1/2CO2(g)+H2O(l) △H=-445kJ/mol
C.已知2C(s)+O2(g)=2CO(g) △H= -221 kJ/mol,则C(碳)的燃烧热为110.5 kJ/mol
D.HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol
参考答案:B
本题解析:
本题难度:简单
3、选择题 一定条件下水分解生成氢气和氧气,有关物质和能量的转化关系如图所示,下列判断正确的是
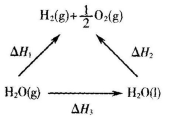
A.△H1 > △H2
B.△H2 < △H3
C.△H1= △H2+ △H3
D.△H1 + △H3> △H2