?
参考答案:(1) 氢气和水蒸气? (2)c d (或d c) a b (或b a) e
(3)
装置
所盛药品
实验现象
结论或解释
B
无水硫酸铜
固体由白色变成蓝色
SO2中含有水蒸气
C
?
固体由黑色变成红色
SO2中含有氢气
本题解析:(1)由于在反应过程中,浓硫酸的密度会逐渐减小,所以在反应后期会产生氢气。又因为气体从溶液中挥发出时一定会带有水蒸气,即SO2中含有的杂质是氢气和水蒸气。
(2)检验氢气可用其还原性,即利用氢气还原氧化铜;检验水蒸气一般用无水硫酸铜,且首先要检验水蒸气;又因为氢气在还原氧化铜时应该是干燥的,所以正确的答案是c d (或d c) a b (或b a) e
(3)见分析(2).
本题难度:一般
2、实验题 (18分)
张明同学对硫酸及其盐的某些性质中进行了如下实验探究。
[实验一 ]探究浓硫酸的氧化性 ]探究浓硫酸的氧化性
 将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略) 将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
 (1)该装置设计上存在明显缺陷,其缺陷是?__________ (1)该装置设计上存在明显缺陷,其缺陷是?__________ _______________________?___。 _______________________?___。
 (2)装置甲中反应的化学方程式是___________?___。 (2)装置甲中反应的化学方程式是___________?___。
 (3)装置乙中的试剂是_____________________________________________________。 (3)装置乙中的试剂是_____________________________________________________。
[实验二 ]探究某硫酸亚铁盐固体是否变质 ]探究某硫酸亚铁盐固体是否变质
 (4)请你帮助张明同学完成如下实验方案: (4)请你帮助张明同学完成如下实验方案:
实验操作
| 预期现象和结论
|  ? ?
| ?
|
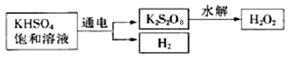
[实验三]用KHSO4制取H2O2并测其质量分数
 查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下: 查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
 张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑) 张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
 ①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化; ①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
 ②用0.1000 mol/L KMnO4溶液滴定; ②用0.1000 mol/L KMnO4溶液滴定;
 ③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。 ③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
 请回答: 请回答:
 (5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。 (5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
 (6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________?___。 (6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________?___。
 (7)原H2O2溶液中溶质的质量分数是__________?_____?____。 (7)原H2O2溶液中溶质的质量分数是__________?_____?____。
参考答案:共18分
 (1)装置乙不应有瓶塞? (2分) (1)装置乙不应有瓶塞? (2分)
 (2)Cu+2H2SO4(浓) (2)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O? (2分) CuSO4+SO2↑+2H2O? (2分)
 (或C+2H2SO4(浓) (或C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,其他合理答案也给分) CO2↑+2SO2↑+2H2O,其他合理答案也给分)
 (3)氢氧化钠溶液(或氢氧化钾溶液等)? (2分) (3)氢氧化钠溶液(或氢氧化钾溶液等)? (2分)
 (4)往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液;? (2分) (4)往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液;? (2分)
若溶液变为红色,说明该固体已变质;若溶液未变红色,说明该固体没有变质? (2分)
 (5)2HSO4――2e-=S2O82-+2H+(或2SO42―-2e-=S2O82-)? (3分) (5)2HSO4――2e-=S2O82-+2H+(或2SO42―-2e-=S2O82-)? (3分)
 (6)催化剂(或加快反应速率)? (2分) (6)催化剂(或加快反应速率)? (2分)
(7)3.4%? (3分)
本题解析:略
本题难度:一般
3、实验题 某研究性学习小组欲开展一次以化学为主题的活动,确定的课题是“研究浓硫酸与木炭粉在加热条件下反应的产物”。
(1)假如你是小组成员,根据你的推测,浓硫酸与木炭粉在加热条件下反应的产物的可能是。
(2)为了验证你的推测,小组讨论确定用以下装置进行实验:
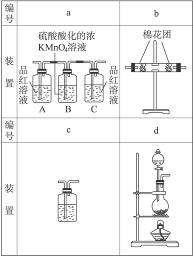
①你认为装置b中所加的固体是_____________;装置C中所加的溶液是_____________。
②甲、乙、丙三位同学分别设计了三套不同的装置如下:
甲的装置顺序:d a b c
乙的装置顺序:d b a c
丙的装置顺序:d c a b
你认为谁设计的顺序合理?为什么?推测合理的顺序中的a、b、c装置中可能出现的实验现象。
参考答案:(1)CO2、SO2、H2O
(2)①无水硫酸铜?澄清石灰水
②乙。甲只能检出二氧化硫和二氧化碳,丙只能检出二氧化碳,而乙既能检出二氧化硫,又能检出二氧化碳,还能检出水。b处变蓝色;a处的A瓶中品红溶液褪色,B瓶中颜色变浅或刚好褪色,C瓶中的品红不褪色;c处的溶液变浑浊。
本题解析:木炭与浓硫酸加热反应生成CO2和SO2。CO2和SO2在化学性质上的相同点都是酸性氧化物,都跟澄清石灰水中的Ca(OH)2反应,使澄清石灰水变浑浊,这会相互干扰鉴别。CO2和SO2在化学性质上的明显不同点为SO2有漂白性,CO2则不然;SO2有较强的还原性,CO2则不然。在SO2、CO2混合气体中,首先用品红检验SO2的存在,然后将SO2氧化除去,再用澄清石灰水检验CO2的存在,是一种确认SO2和CO2共存的好方案。
由于对CO2、SO2的确认都是在水溶液中进行的,所以应在确认CO2和SO2之前确认H2O。与H2O发生作用并伴有明显现象的物质,中学生应该熟知的是无水CuSO4。白色的CuSO4粉末与H2O反应生成蓝色的CuSO4·5H2O晶体。CuSO4与CO2和SO2都不发生任何作用。
本题难度:简单
4、选择题 下列有关浓硝酸与浓硫酸的叙述中,正确的是(?)
A.常温下都能用铝容器贮存
B.露置在空气中,容器内酸液的质量都增加
C.常温下都能与铜较快反应
D.露置在空气中,容器内酸液的质量都减少
参考答案:  A A
本题解析:常温下,铝在浓硫酸和浓硝酸中会发生钝化,因此选项A正确;浓硝酸易挥发,所以露置在空气中溶液的质量减少,而浓硫酸具有吸水性,溶液的质量是增加的,选项B和D不正确;铜和浓硫酸反应需要加热,C不正确,答案选A。
本题难度:一般
5、选择题 将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体可能是 (? )
A.CO2
B.NH3
C.C12
D.HCl
参考答案:BC
本题解析:A、二氧化碳是酸性气体,和二氧化硫以及氯化钡均不反应,不会产生沉淀物,故A错误;
B、2NH3+SO2═(NH4)2S03,(NH4)2S03+BaCl2═BaSO3↓+2NH4Cl,故B正确;
C、Cl2+SO2+2H2O═H2SO4+2HCl,H2SO4+BaCl2═BaSO4↓+2HCl,故C正确;
D、HCl是酸性气体,和二氧化硫以及氯化钡均不反应,不会产生沉淀物,故D错误。
故选BC。
点评:本题目考查了物质之间的化学反应,要求学生熟记教材知识,学以致用。
本题难度:一般
|