微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.SO2有漂白性,所以能使品红溶液、溴水、KMnO4溶液褪色
B.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
C.能使品红溶液褪色的不一定是SO2
D.SO2和Cl2都能漂白,若将两种气体同时通入,漂白效果会更好
参考答案:A.二氧化硫与溴水、KMnO4溶液均发生氧化还原反应,则体现其还原性,只有使品红褪色体现其漂白性,故A错误;
B.二氧化硫与有色物质化合生成无色物质,活性炭具有吸附性,漂白粉、Na2O2都具有强氧化性,使红墨水褪色,漂白原理不同,故B错误;
C.SO2、漂白粉、活性炭、Na2O2都能使品红溶液褪色,则能使品红溶液褪色的不一定是SO2,故C正确;
D.两种气体同时通入生成硫酸和盐酸,均不具有漂白性,漂白效果减弱,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 下述实验能达到预期目的是( )
| 编号 | 实验内容 | 实验目的
A
在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液后红色褪去
验证Na2CO3溶液中存在水解平衡
B
?将SO2通入中KMnO4溶液中
验证SO2具有漂白性
C
淀粉溶液和稀H2SO4混合加热,后加新制的Cu(OH)2悬浊液加热至沸腾
检验淀粉水解产物有还原性
D
将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中
检验气体中含有乙烯
|
A.A
B.B
C.C
D.D
参考答案:A.因Na2CO3溶液中存在水解平衡,加入CaC12溶液,碳酸根离子与钙离子结合生成沉淀,导致水解平衡逆向移动,c(OH-)减小,所以红色褪去,故A正确;
B.将SO2通入中KMnO4溶液中发生氧化还原反应,说明SO2具有还原性,故B错误;
C.淀粉溶液和稀H2SO4混合加热,水解后生成葡萄糖,然后应加碱中和酸至碱性,然后加新制的Cu(OH)2悬浊液加热至沸腾检验葡萄糖,故C错误;
D.乙醇易挥发,且乙醇能被高锰酸钾氧化,所以将乙醇与浓硫酸共热制得的气体中有乙烯和乙醇,通入酸性KMnO4溶液中褪色,不能确定一定是乙烯,故D错误;
故选A.
本题解析:
本题难度:一般
3、简答题 I.(1)指出下列实验用品或仪器(已经洗涤干净)使用时的第一步操作:
①蓝色石蕊试纸(检验气体性质)______;
②容量瓶______;
③托盘天平______.
(2)下列有关化学实验操作中“先”与“后”的说法正确的是______(填代号).
A.用排水法收集气体后,先移出导管,后熄灭酒精灯
B.点燃可燃性气体(如CH4、H2、CO等)时,都要先检验气体纯度,后点燃
C.碱液流到桌子上,先用稀醋酸溶液中和,后用水洗
D.给试管加热时,先均匀加热,后局部加热
II.实验室利用SO2和一定浓度的NaOH溶液反应制备少量NaHSO3.实验装置如图所示:
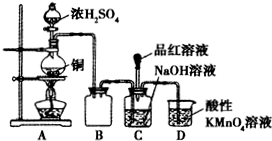
请回答下列问题:
(1)写出圆底烧瓶中发生反应的化学方程式______.
(2)反应结束后发现烧瓶中还有少量的铜片剩余,有人认为还有一定的硫酸剩余,原因是______,在不增加硫酸的情况下,要使剩余铜片溶解,可再加入______固体(填写两种不同类别的物质).
(3)装置B的作用是______,装置D的作用是______.
(4)证明C装置中NaOH溶液全部转化为NaHSO3的实验操作和现象是______.
参考答案:I.(1)①石蕊遇酸碱变色时需要在酸碱发生电离的情况下进行,则用蓝色石蕊试纸来检验气体性质时试纸应用蒸馏水润湿,故答案为:用蒸馏水润湿;?
②容量瓶使用之前应先检查是否漏水,漏水的容量瓶不能用来配制溶液,故答案为:检验是否漏水;
③托盘天平使用之前应先调节天平平衡,否则称量的质量不准确,故答案为:游码归零,调节天平平衡;
(2)A.用排水法收集气体后,先移出导管,后熄灭酒精灯,是为了防止水倒吸,故A正确;
B.点燃可燃性气体(如CH4、H2、CO等)时,都要先检验气体纯度,后点燃,是为防止气体不纯而发生爆炸,故B正确;
C.碱液流到桌子上,先用稀醋酸溶液中和,后用水洗,降低碱性来减小腐蚀,故C正确;
D.给试管加热时,先均匀加热,后局部加热,是为防止试管局部受热而使试管炸裂,故D正确;
故答案为:ABCD;
II.(1)Cu与浓硫酸在加热时反应生成硫酸铜、二氧化硫和水,反应为Cu+2H2SO4(浓)?△?.??CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)?△?.??CuSO4+SO2↑+2H2O;
(2)因随着反应进行,硫酸越来越稀,铜和稀硫酸不反应,所以有硫酸剩余,在酸性条件下,硝酸盐具有硝酸的强氧化性,能使Cu溶解,
也可利用酸性条件下产生的铁离子与Cu发生氧化还原反应使之溶解,则可加入NaNO3、Fe2O3固体,
故答案为:随着反应进行,硫酸越来越稀,铜和稀硫酸不反应,所以有硫酸剩余;NaNO3、Fe2O3;?
(3)由图可知,装置B中的导管较短,则装置B可防止碱液被吸入A装置中,从而起到安全瓶(防止倒吸)的作用,二氧化硫有毒,不能排放在环境中,则D中的高锰酸钾与二氧化硫发生反应而使多余的二氧化硫被吸收,
故答案为:安全瓶(防止倒吸);吸收多余的SO2;?
(4)二氧化硫过量时,碱反应生成NaHSO3,且过量的二氧化硫使品红褪色,故答案为:把品红溶液滴入C装置反应后的溶液中,若品红溶液褪色,证明NaOH溶液全部转化为NaHSO3.
本题解析:
本题难度:一般
4、选择题 下列实验报告记录的实验现象正确的是
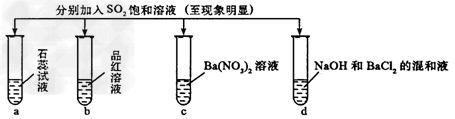
[? ]
a
b
c
d
A.
无色
无色
无现象
无色溶液
B.
红色
无色
白色沉淀
白色沉淀
C.
红色
无色
无色溶液
白色沉淀
D.
无色
无色
无色溶液
无色溶液
参考答案:B
本题解析:
本题难度:简单
5、选择题 化学中常用类比的方法可预测许多物质的性质.如根据H2+Cl2=2HCl推测:H2+Br2=2HBr.
但类比是相对的,如根据2Na2O2+2CO2=Na2CO3+O2,类推2Na2O2+2SO2=Na2SO3+O2是错误的,应该是Na2O2+SO2=Na2SO4.
下列各组类比中正确的是( )
A.由Fe+S═FeS推测:Fe+Cl2═FeCl2
B.由2CO2+Ca(ClO)2+2H2O=Ca(HCO3)2+2HClO,推测:CO2+NaClO+H2O=NaHCO3+HClO
C.由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
D.由Na2SO3+2HCl=2NaCl+H2O+SO2↑,推测:Na2SO3+2HNO3=2NaNO3+H2O+SO2↑
参考答案:B
本题解析:
本题难度:简单