|
高中化学知识点总结《物质的量》高频考点强化练习(2017年最新版)(四)
2017-08-10 00:47:34
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NaCl溶液的物质的量浓度的含义是
A.每升水含NaCl的质量
B.每升溶液含NaCl的质量
C.每升水含NaCl的物质的量
D.每升溶液含NaCl的物质的量
|
参考答案:D
本题解析:NaCl溶液的物质的量浓度为每升溶液含NaCl的物质的量,选D。
考点:考查物质的量浓度的含义。
本题难度:一般
2、简答题 下面是几种实验中常用的仪器:
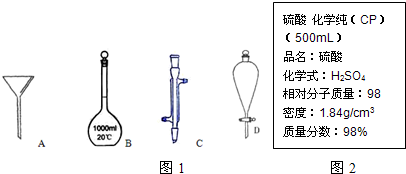
(1)写出图1序号所代表的仪器的名称:B______;C______;D______.
(2)图2是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
现用该浓硫酸配制100mL 1mol/L的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.
请回答下列问题:
Ⅰ配制稀硫酸时,上述仪器中不需要使用的有______(选填序号),还缺少的仪器有______(写仪器名称);
Ⅱ经计算,该浓硫酸的物质的量浓度为______mol/L.配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为______mL(保留一位小数),量取浓硫酸时应选用______(选填①10mL、②50mL、③100mL)规格的量筒;
Ⅲ用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是______(填序号);
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓盐酸
D.重新配制
Ⅳ用该浓硫酸配制100mL1mol/L稀硫酸的正确顺序是______;
A.冷却?B.量取?C.洗涤?D.定容?E.溶解?F.摇匀?G.移液
Ⅴ将所配制的稀硫酸进行测定,发现浓度大于1mol/L.请你分析配制过程中可能引起该误差的原因是(填序号)______;
①容量瓶不干燥,含有少量蒸馏水?②定容时俯视刻度线?③定容时仰视刻度线
④未冷却至室温就转移到容量瓶中?⑤没有洗涤烧杯和玻璃棒
Ⅵ请写出“定容”的具体操作:______.
参考答案:(1)图中各仪器的名称是:B为1000ml容量瓶,C为冷凝管,D为分液漏斗,故答案为:1000ml容量瓶;冷凝管;分液漏斗;
(2)Ⅰ配制稀硫酸时,上述仪器中不需要使用的有②④⑥,还需要的仪器有:配制溶液的仪器100mL容量瓶、起引流和搅拌作用的玻璃棒,故答案为:②④⑥,100mL容量瓶、玻璃棒;
ⅡC=103ρwM=103×1.84×98%98mol/L=18.4mol/L,稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以
18.4 mol/L×V=1mol/L×0.1L,V=0.0054L=5.4mL,所以应该选取10mL量筒,
故答案为:18.4;5.4;①;
Ⅲ用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,应该重新配制,故选D;
Ⅳ配制时,一般可分为以下几个步骤:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀,所以其排列顺序为:BEAGCGDF,故答案为:BEAGCGDF;
Ⅴ①容量瓶不干燥,含有少量蒸馏水,溶质的物质的量和溶液的体积都不变,所以无影响;
?②定容时俯视刻度线,溶液的体积偏小,配制溶液的浓度偏大;?
③定容时仰视刻度线,溶液的体积偏大,配制溶液的浓度偏小;
④未冷却至室温就转移到容量瓶中,溶液的体积偏小,配制溶液的浓度偏大;?
⑤没有洗涤烧杯和玻璃棒,溶质的物质的量偏小,配制溶液的浓度偏低;
故选②④;
Ⅵ定容时的操作是:加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切,
故答案为:加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切.
本题解析:
本题难度:一般
3、选择题 设NA表示阿伏加德罗常数的值。下列叙述正确的是(?)。
A.42 g C3H6中含有的共用电子对数目为8 NA
B.电解饱和食盐水时,当0.1 mol NaCl反应时,转移的电子数为0.1 NA
C.常温常压下,22.4 L N2和O2的混合气体中含有的分子数目为NA
D.1 L 0.01 mol·L-1 KAl(SO4)2溶液中含有的阳离子数目为0.02 NA
参考答案:B
本题解析:有关NA的问题,解答时应对各种“陷阱”了如指掌,避免犯错。A项,注意1个CC中含2对共用电子对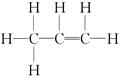 ,1 mol C3H6中含有共用电子对数为9 NA,错误。B项,发生反应2NaCl+2H2O ,1 mol C3H6中含有共用电子对数为9 NA,错误。B项,发生反应2NaCl+2H2O 2NaOH+H2↑+Cl2↑,当0.1 mol NaCl反应时,转移电子数为0.1 NA,正确。C项,状态为常温常压,此时气体的摩尔体积大于22.4 L·mol-1,22.4 L混合气体的分子数小于NA。D项,由于Al3+水解:Al3++3H2O?Al(OH)3+3H+,则阳离子数目大于0.02 NA,错误。 2NaOH+H2↑+Cl2↑,当0.1 mol NaCl反应时,转移电子数为0.1 NA,正确。C项,状态为常温常压,此时气体的摩尔体积大于22.4 L·mol-1,22.4 L混合气体的分子数小于NA。D项,由于Al3+水解:Al3++3H2O?Al(OH)3+3H+,则阳离子数目大于0.02 NA,错误。
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,60g甲醛、乙酸与葡萄糖混合物充分燃烧消耗氧气分子数为2NA
B.常温常压下,22.4L氯气与足量镁粉充分反应,转移电子数为2NA
C.标准状况下,11.2LCCl4含有的分子数目为0.5NA
D.标准状况下,22.4L氦气所含原子数为2NA
参考答案:A
本题解析:A、甲醛、乙酸与葡萄糖的实验式相同,是CH2O,1mol甲醛燃烧消耗氧气为1mol,60g甲醛的物质的量是2mol,燃烧消耗氧气为2mol,1mol乙酸燃烧消耗氧气为2mol,60g乙酸的物质的量是1mol,燃烧消耗氧气为2mol,同理可得60g葡萄糖燃烧消耗氧气也为2mol,因此三者以任意比例混合,质量一定时,燃烧消耗氧气是相同的,正确;B、常温常压不是标准状况,22.4L氯气不是1mol,错误;C、CCl4是液态,错误;D、氦气是单原子分子,错误。
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的值,如果ag某气体双原子分子的分子数为p,则bg该气体在标准状况下的体积V(L)是( )
参考答案:D
本题解析:分子数是p,则该气体的物质的量是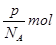 ,所以该气体的相对分子质量是 ,所以该气体的相对分子质量是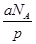 ,所以bg该气体的物质的量是 ,所以bg该气体的物质的量是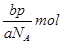 ,因此在标准状况下的体积是 ,因此在标准状况下的体积是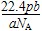 ,答案选D。 ,答案选D。
本题难度:一般
|