微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列操作中正确的是
A.过滤时,玻璃棒要不断搅拌以加快过滤速度
B.过滤时,漏斗下端紧贴烧杯底部
C.加热试管内物质时,用外焰加热
D.向试管中滴加液体时,胶体滴管伸入液面以下
参考答案:C
本题解析:分析:A、过滤时,不能用玻璃棒搅拌漏斗中的液体,防止损坏滤纸;
B、过滤时,漏斗下端紧贴烧烧杯内壁,防止液体溅出;
C、加热试管内物质时,用外焰加热;
D、胶头滴管伸入试管内,会造成药品的污染;
解答:A、过滤时,不能用玻璃棒搅拌漏斗中的液体,防止损坏滤纸,故A错误;
B、过滤时,漏斗下端紧贴烧烧杯内壁,防止液体溅出,故B错误;
C、加热试管内物质时,用外焰加热,故C正确;
D、胶头滴管伸入试管内,会造成药品的污染,故D错误;
故选:C.
点评:本题难度不大,掌握常见化学实验基本操作的注意事项是解答此类试题的关键,注意基础知识的积累.
本题难度:简单
2、选择题 下列推断或表述正确的是
A.分别将体积各为1L的1mol/L NaCI溶液和1mol/L的NaF溶液加水稀释至100L,两溶液离子总数相等
B.将pH =a的醋酸溶液稀释100倍,稀释液pH=b,则b=a+2
C.0.2mol/L的盐酸与0.05mol/L的Ba( OH)2溶液等体积混合,混合液pH =1
D.向1L,0.3mol/L的NaOH溶液缓缓通入CO2气体,至溶液质量增加8.8g,则溶液中:
参考答案:D
本题解析:试题分析:A、NaF是强碱弱酸盐,会发生水解,故错;B、醋酸是弱酸,弱电解质,存在电离平衡,b<a+2,故错;C、最后溶液的浓度为0.05mol/L,故错。故选D。
考点:盐类的水解 电离平衡 pH计算
点评:本题考查的是盐类的水解、电离平衡、pH计算的知识,题目难度中,熟悉各个平衡的原理是解题的关键。
本题难度:困难
3、选择题 下图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是
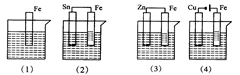
A.⑷>⑵>⑶>⑴
B.⑵>⑴>⑶>⑷
C.⑷>⑵>⑴>⑶
D.⑶>⑵>⑷>⑴
参考答案:C
本题解析:试题分析:金属在同一电解质溶液中:电解引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。因此⑷中Fe做电解池的阳极,腐蚀最快;⑵中Sn、Fe构成原电池,Fe比Sn更活泼,铁做负极被氧化腐蚀;⑴中Fe仅发生化学腐蚀;⑶中Zn、Fe构成原电池,Zn比Fe更活泼,Fe做正极被保护,所以本题应选C。
考点:本题考查的是金属的腐蚀与原电池、电解池的关系。
本题难度:困难
4、选择题 在下列物质种类中,前者包含后者的是
A.混合物 溶液
B.电解质 化合物
C.浊液 胶体
D.酸性氧化物 非金属氧化物
参考答案:A
本题解析:考查物质的分类
A:溶液均为分散系,一定为混合物,正确
B:电解质一定为化合物,但化合物不一定为电解质,排除
C:浊液与胶体均为分散系,互不交叉,排除
D:两者互有交叉,例如CO为非金属氧化物,但不属于酸性氧化物,排除
答案为A
本题难度:简单
5、填空题 (10分)实验室常用二氧化锰和浓盐酸反应制取氯气,反应式如下:
MnO2+ 4HCl(浓)=MnCl2+Cl2↑+2H2O
(1)用双线桥法表示上述反应中电子转移的方向和数目。
(2)反应中发生氧化反应的物质是___________(填化学式),被还原的元素是___________(填元素名称)。
(3)氧化剂与还原剂的物质的量之比为_________________。
(4)若反应中被氧化的盐酸为1mol,则生成的氯气体积为 (标准状况下)。
参考答案:(10分)(1)

(2) HCl 锰
(3) 1
本题解析:
本题难度:一般