微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中有关物质的量浓度关系和计算不正确的是?
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl)?
B.已知25°C时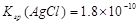 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到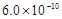 mol·L-1
mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
参考答案:C
本题解析:C错;设溶液的体积各为1L;即0.2mol·L-1 HCl溶液中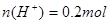 ;0.05 mol·L-1 Ba(OH)2溶液中
;0.05 mol·L-1 Ba(OH)2溶液中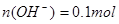 ;混合后,溶液中
;混合后,溶液中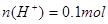 ,混合后溶液中
,混合后溶液中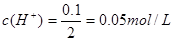 ,此时溶液的pH=1.3
,此时溶液的pH=1.3
本题难度:一般
2、选择题 下列关于pH=12的Na2CO3溶液说法正确的是
A.升高溶液温度,溶液pH增大
B.c(Na+) +c(H+)=c(CO32-)+ c(HCO3-)+ c(OH-)
C.溶液中c(OH-)>c(HCO3-)> c(H+)
D.2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3)
参考答案:AC
本题解析:碳酸钠是强碱弱酸盐,少部分碳酸根离子能够水解,即CO32—+H2O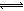 HCO3—+OH—,该水解反应是吸热反应,升高温度,促进碳酸根离子水解,氢氧根离子浓度增大,溶液的pH增大,故A选项正确;B项,违反电荷守恒原理,碳酸钠溶液中存在Na+、H+、CO32-、HCO3-、OH-,由于溶液呈电中性,则阳离子的正电荷总浓度等于阴离子的负电荷总浓度,即c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故B选项错误;碳酸根离子的水解分两步进行,CO32—+H2O
HCO3—+OH—,该水解反应是吸热反应,升高温度,促进碳酸根离子水解,氢氧根离子浓度增大,溶液的pH增大,故A选项正确;B项,违反电荷守恒原理,碳酸钠溶液中存在Na+、H+、CO32-、HCO3-、OH-,由于溶液呈电中性,则阳离子的正电荷总浓度等于阴离子的负电荷总浓度,即c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故B选项错误;碳酸根离子的水解分两步进行,CO32—+H2O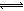 HCO3—+OH—,HCO3—+H2O
HCO3—+OH—,HCO3—+H2O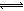 H2CO3+OH—,第一步水解程度大于第二步水解,碳酸钠溶液呈碱性,则溶液中c(OH-)>c(HCO3-)> c(H+),故C选项正确;D项,违反物料守恒原理,因为碳酸钠中钠离子是碳酸根离子的2倍,则平衡时溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D选项错误。
H2CO3+OH—,第一步水解程度大于第二步水解,碳酸钠溶液呈碱性,则溶液中c(OH-)>c(HCO3-)> c(H+),故C选项正确;D项,违反物料守恒原理,因为碳酸钠中钠离子是碳酸根离子的2倍,则平衡时溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D选项错误。
本题难度:一般
3、填空题 (18分)以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—99.3%)的工艺流程为(可能用到的原子量Cl 35.5? Ca 40? O 16)
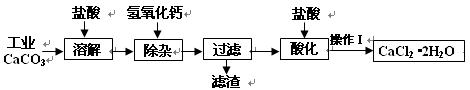
(1)CaCO3与盐酸反应的离子方程式??。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为??。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有?。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:
①?,②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括?、?、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L? AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 ?.(只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为?。
参考答案:(18分)
(1)CaCO3+2H+=Ca2++CO2↑+H2O(3分)
(2)①Al(OH)3、Fe(OH)3(2分),②普通漏斗(2分)
(3)除去过量的氢氧化钙(2分,合理则给分);
(4)(蒸发2分、结晶2分),(或写蒸发浓缩、降温结晶)
(5)① 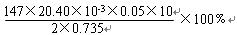 ?(3分)
?(3分)
②样品中存在少量的NaCl (2分,合理则给分如少量的CaCl2·2H2O失水等)
本题解析:略
本题难度:一般
4、选择题 我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A.有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
参考答案:D
本题解析:A、除去硫酸根的同时,引入了新的杂质硝酸根,错误;B、要得到钠和氯气需要电解熔融的NaCl,错误;C、增加氯离子的量,AgCl的沉淀溶解平衡向逆向移动,溶解度减小,错误;D、纯碱水解呈碱性,正确。
【考点定位】考查化学实验与化学反应基本原理,涉及除杂、沉淀溶解平衡、盐类水解等知识。
本题难度:一般
5、选择题 物质的浓度相同的三种盐,NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ 酸性由强到弱的顺序是(?)
A.HX>HZ>HY
B.HZ>HY>HX
C.HX>HY>HZ
D.HY>HZ>HX
参考答案:C
本题解析:酸越弱,相应的钠盐越容易水解,溶液的减小就越强。物质的浓度相同的三种盐,NaX、NaY、NaZ的溶液,其pH依次为8、9、10,所以HX、HY、HZ 酸性由强到弱的顺序是HX>HY>HZ,答案选C。
本题难度:一般