微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是( )
A.碳酸的电离?H2CO3?H++HCO3-
B.将金属钠加入水中?Na+2H2O=Na++2OH-+H2↑
C.硫化钠水解?S2-+2H2O=H2S↑+2OH-
D.向氯化铝溶液中加入过量的烧碱溶液?Al3++3OH-=Al(OH?)3↓
参考答案:A.碳酸的电离方程式为H2CO3?H++HCO3-,故A正确;
B.将金属钠加入水中的离子反应为2Na+2H2O=2Na++2OH-+H2↑,故B错误;
C.硫化钠水解的离子反应为S2-+H2O?HS-+OH-,故C错误;
D.向氯化铝溶液中加入过量的烧碱溶液的离子反应为Al3++4OH-=AlO2-+2H2O,故D错误;
故选A.
本题解析:
本题难度:一般
2、选择题 下列反应的离子方程式书写正确的是( )
A.硫酸与氢氧化钡溶液反应:H++OH-=H2O
B.用FeCl3腐蚀Cu制作印刷电路板:Fe3++Cu=Fe2++Cu2+
C.向氯化铝溶液中加入过量的氨水:Al3++4OH-=AlO2-+2H2O
D.实验室用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O
参考答案:A.硫酸与氢氧化钡溶液反应的离子反应为Ba2++SO42-+2H++2OH-=2H2O+BaSO4↓,故A错误;
B.用FeCl3腐蚀Cu制作印刷电路板的离子反应为2Fe3++Cu=2Fe2++Cu2+,故B错误;
C.向氯化铝溶液中加入过量的氨水的离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故C错误;
D.实验室用氢氧化钠溶液吸收多余的Cl2的离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表。以下推断正确的是?
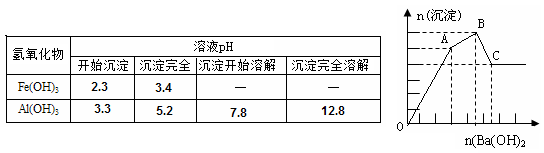
A.C点的沉淀为:Fe(OH)3
B.OA段可能发生的反应有:3Ba2+ +6OH- +3SO42- +2Fe3+ →3BaSO4↓+2Fe(OH)3↓
C.AB段可能发生的反应是:2SO42- +2Ba2+ +Al3+ +3OH-→2BaSO4↓+Al(OH)3↓
D.据图计算原溶液中c(Cl-)>c(SO42-)
参考答案:B
本题解析:向含Al2(SO4)3和 FeCl3的混合溶液与Ba(OH)2溶液反应的实质是Fe3+,Al3+与OH-、Ba2+与SO42-之间的离子反应,如下:Ba2++SO42-═BaSO4↓,Fe3++3OH-=Fe(OH)3↓,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,假设1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3mol,提供6molOH-,图表分析铁离子先沉淀,由图象分析,OA段为加入3molBa(OH)2,发生反应Ba2++SO42-═BaSO4↓,得到3molBaSO4沉淀,C点为氢氧化铝溶解后的沉淀物质的量为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀3mol钡离了,1mol铁离子和1mol铝离子;AB段为沉淀1mol铝离子;BC段为溶解氢氧化铝消耗氢氧化钡1mol;A、分析可知,C点沉淀为BaSO4和Fe(OH)3,故A错误;B、OA段可能发生的反应有沉淀钡离子,铁离子,铝离子,反应为,3Ba2++6OH-+3SO42-+Al3++Fe3+→3BaSO4↓+Fe(OH)3↓+Al(OH)3↓,也可能发生3Ba2++6OH-+3SO42-+2Fe3+→3BaSO4↓+2Fe(OH)3↓,故B正确;C、AB段可能发生的反应是Al3++3OH-→Al(OH)3↓,故C错误;D、图象分析FeCl3、Al2(SO4)3的混和溶液中含FeCl3、1mol,含Al2(SO4)31mol,c(Cl-)=c(SO42-),故D错误;
本题难度:一般
4、填空题 (10分)(1)写出下列物质在水溶液中的电离方程式
氢氧化钡?硫酸铝?
(2)写出下列反应的离子方程式或化学方程式:
硫酸溶液与澄清的石灰水混合?
碳酸氢钠溶液与稀盐酸混合? ?
?
MgO + 2H+ ==Mg2+ + H2O_____________________________________________
参考答案: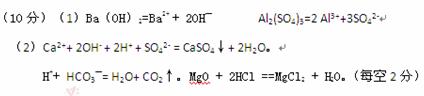
本题解析:略
本题难度:简单
5、选择题 下列离子方程式正确的是( )
A.氢氧化钡溶液中滴加硫酸氢钠:Ba2++OH-+H++SO42-═BaSO4↓+H2O
B.铝与氯化铜溶液反应:Al+Cu2+═Al3++Cu
C.在H2C2O4中加入酸性KMnO4溶液:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
D.5.6g?Fe与200mL2.0mol/L?HNO3溶液充分反应:3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O
参考答案:A、氧化钡溶液中滴加硫酸氢钠,硫酸氢钠全部反应,反应的离子方程式为:Ba2++OH-+H++SO42-═BaSO4↓+H2O,故A正确 ;
B、铝与氯化铜溶液反应离子方程式应为:2Al+3Cu2+═2Al3++3Cu,故B错误;
C、在H2C2O4中加入酸性KMnO4溶液,被氧化为二氧化碳,高锰酸钾被还原为锰离子,反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,故C正确;
D、5.6g?Fe物质的量为0.1mol,200mL2.0mol/L?HNO3溶液中硝酸物质的量为0.4mol,充分反应生成三价铁离子,反应的离子方程式为:Fe+NO3-+4H+═Fe3++NO↑+2H2O,故D错误;
故选C.
本题解析:
本题难度:简单