| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《离子方程式的书写及正误判断》试题巩固(2017年最新版)(六)
参考答案:AD 本题解析:A选项正确,B选项中醋酸为弱电解质,不能拆;C选项中氢氧化铝不能溶于氨水,所以生成的不是偏铝酸根,而是氢氧化铝沉淀。D选项正确。 本题难度:简单 2、选择题 下列表示对应化学反应的离子方程式正确的是 |
参考答案:A
本题解析:A.将过量SO2通入冷氨水中:SO2+NH3·H2O HSO3-+NH4+,故A正确。B.漏掉了HCO3-与OH-的反应,故B错误。C.酸性溶液中不会生成OH-,故C错误。D.不符合电子守恒,故D错误。
HSO3-+NH4+,故A正确。B.漏掉了HCO3-与OH-的反应,故B错误。C.酸性溶液中不会生成OH-,故C错误。D.不符合电子守恒,故D错误。
考点:了解离子反应的概念、离子反应方程式的书写。
点评:离子方程式正误判断要在掌握基本方法的基础上,针对反应中物质的性质、反应的条件、物质的用量、反应的环境等因素具体分析,正确判断。特别是氧化还原反应的离子方程式书写一定符合“三守恒”:原子守恒,电荷守恒和电子守恒。
本题难度:一般
3、填空题 (4分)写出下列反应的离子方程式:
(1)铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2中加入,铜屑可以逐渐溶解,该反应的离子方程式: 。
(2)脱去天然气中的硫化氢既能减少环境污染,又可回收硫资源。其中硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为: 。
参考答案:(1)H2O2 + Cu + 2H+ = Cu2+ + 2H2O (2)2Fe3+ + H2S = S+ 2Fe2+ + 2H+
本题解析:(1)双氧水具有氧化性,能氧化单质铜,方程式是H2O2 + Cu + 2H+ = Cu2+ + 2H2O。
(2)氯化铁溶液具有氧化性,能氧化硫化氢生成单质S,反应的方程式是
2Fe3+ + H2S = S+ 2Fe2+ + 2H+。
本题难度:一般
4、选择题 下列实验设计及其对应的离子方程式均正确的是 ( )
A.用烧碱溶液吸收少量二氧化硫 :SO2 + OH-= HSO3-
B.用FeCl3溶液腐蚀铜线路板:Cu + Fe3+= Cu2+ + Fe2+
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用惰性电极电解饱和氯化钠溶液:2Cl- + 2 H2O 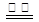 H2↑+ Cl2↑+ 2OH-
H2↑+ Cl2↑+ 2OH-
参考答案:D
本题解析:A错,正确为:SO2 + 2OH- =H2O +SO32—;B错,电荷未守恒;C错,正确离子方程式为:Cl2 + H2O = H+ + Cl- + HClO;D正确;
本题难度:一般
5、选择题 下列各离子方程书写正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++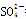 ===BaSO4↓+H2O
===BaSO4↓+H2O
B.将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
C.在FeI2溶液中通入少量的氯气:2Fe2++ Cl2 = 2Fe3+ + 2Cl-
D.Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O
参考答案:B
本题解析:A、H2SO4与Ba(OH)2溶液反应应为:Ba2++2OH-+2H++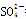 ===BaSO4↓+2H2O,错误;B、将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑,正确;C、还原性:I->Fe2+,FeI2溶液中通入少量的氯气:2 I- + Cl2 = 2Fe3+ + I2,错误;D、Fe(OH)3与足量的HI溶液反应,漏掉碘离子和铁离子之间的氧化还原反应,错误。
===BaSO4↓+2H2O,错误;B、将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑,正确;C、还原性:I->Fe2+,FeI2溶液中通入少量的氯气:2 I- + Cl2 = 2Fe3+ + I2,错误;D、Fe(OH)3与足量的HI溶液反应,漏掉碘离子和铁离子之间的氧化还原反应,错误。
考点:考查离子方程式正误判断。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《新型材料》.. | |