微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 判断下列有关化学基本概念的依据正确的是( )
A.电解质:水溶液里能否导电
B.共价化合物:是否含有共价键
C.氧化还原反应:反应前后元素化合价是否变化
D.强弱电解质:溶液的导电能力大小
参考答案:C
本题解析:解析:A.电解质是在水溶液中或熔融状态下能导电的化合物,熔融状态下能导电的化合物也是电解质,故A错误;?
B.含有共价键的化合物不一定为共价化合物离子化合物中也可能含有共价键,如NaOH,故B错误;
C.氧化还原反应的特征是有化合价的变化,可以根据元素化合价是否变化来确定是否是氧化还原反应,故C正确;
D.溶液的导电能力和电解质的强弱无关,根据电解质在水溶液中是否完全电离将电解质分为强电解质和弱电解质,故D错误.
故选C.
本题难度:一般
2、填空题 在反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是______,氧化产物是______,氧化产物与还原产物的物质的量之比为______,被氧化与未被氧化的HCl的质量之比为______,若有73gHCl被氧化,电子转移的总数为______,产生Cl2的质量为______g.
参考答案:氧化还原反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价升高的Cl元素被氧化,对应产物Cl2是氧化产物,化合价降低的Mn元素被还原,所在的反应物KMnO4是氧化剂,发生还原反应,对应产物MnCl2是还原产物,氧化产物与还原产物的物质的量之比为5:2,在反应的16HCl(浓)中,被氧化的占10mol,未被氧化的HCl为6mol,被氧化与未被氧化的HCl的质量之比为5:3,当有10mol即365g盐酸被氧化时,转移电子的物质的量为10mol,生成的氯气物质的量为5mol,若有73g即2molHCl被氧化,转移电子的物质的量为2mol即1.204×1024个,产生Cl2的物质的量为1mol,质量为71g,故答案为:KMnO4;Cl2;5:2;5:3;1.204×1024;71.
本题解析:
本题难度:一般
3、选择题 氯化碘(ICl)与Cl2性质相似,可发生下列反应,①2ICl+2Mg═MgI2+MgCl2②ICl+H2O═HCl+HIO.对上述两个反应的有关说法正确的是( )
A.ICl是一种新的卤素单质
B.反应①中MgI2既是氧化产物,又是还原产物
C.反应②中ICl既是氧化剂,又是还原剂
D.固态ICl是一种离子晶体
参考答案:A.ICl是不同元素形成的化合物,故A错误;
B.反应①中ICl中I元素的化合价为+1价,MgI2中I元素的化合价为-1价,Mg元素化合价升高,则MgI2既是氧化产物,又是还原产物,故B正确;
C.反应②中各元素的化合价都没有发生变化,不是氧化还原反应,故C错误;
D.ICl为共价化合物,属于分子晶体,故D错误.
故选B.
本题解析:
本题难度:简单
4、填空题 在2FeCl3+2KI═2FeCl2+2KCl+I2反应中:
(1)______元素被氧化,______是还原产物
(2)该反应的离子方程式为:______
(3)FeCl3的氧化性______I2的氧化性(填“>”、“<”).
(4)请用“双线桥法”标出该反应电子转移的方向和数目.
参考答案:(1)在2FeCl3+2KI═2FeCl2+2KCl+I2 反应中,碘元素化合价从-1价变化为0价,化合价升高时做还原剂,KI被氧化发生氧化反应,铁元素化合价从+3价降低到+2价,化合价降低做氧化剂,被还原得到还原产物FeCl2,故答案为:I;FeCl2;
(2)该反应的离子方程式为:2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(3)氧化还原反应中的氧化剂FeCl3的氧化性大于氧化产物I2,故答案为:>;
(4)铁元素化合价从+3价变化为+2价得到电子;碘元素化合价从-1价变化为0价,用双线桥标注电子转移:
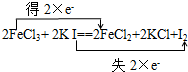
,
故答案为:
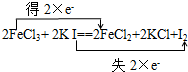
.
本题解析:
本题难度:一般
5、选择题 下列氧化还原反应中,实际参加反应的氧化剂与还原剂物质的量之比正确的是( )
①2H2S+SO2=3S+2H2O;?2:1
②6HNO3(浓)+S=H2SO4+6NO2+2H2O;?1:6
③Fe+4HNO3=Fe(NO3)3+NO+2H2O;?1:1
④Si+2NaOH+H2O=Na2SiO3+2H2;?3:1.
A.只有①正确
B.只有③
C.只有①和④
D.①②③④都正确
参考答案:①2H2S+SO2=3S+2H2O中,SO2为氧化剂,H2S为还原剂,实际参加反应的氧化剂与还原剂物质的量之比为1:2,故①错误;
②6HNO3(浓)+S=H2SO4+6NO2+2H2O中,HNO3为氧化剂,S为还原剂,实际参加反应的氧化剂与还原剂物质的量之比为6:1,故②错误;
③Fe+4HNO3=Fe(NO3)3+NO+2H2O中,HNO3为氧化剂,Fe为还原剂,实际参加反应的氧化剂与还原剂物质的量之比为1:1,故③正确;
④Si+2NaOH+H2O=Na2SiO3+2H2↑中,H2O为氧化剂,Si为还原剂,实际参加反应的氧化剂与还原剂物质的量之比为2:1,故④错误;
故选B.
本题解析:
本题难度:简单