微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 Ⅰ(1)玻璃棒是中学化学实验中常用的仪器.下列过程中,一般不需要玻璃棒的是______(?填写编号?)
①用PH试纸测定Na2CO3溶液的PH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2?8H2O晶体和NH4Cl晶体反应过程中的能量变化.
⑤实验室用新制备的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)用“大于”“等于”“小于”填空
①读量筒中液体的体积时,视线偏高,读取的体积数______实际体积数
②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称食盐的质量______10.4g
③配制500ml?0.1mol/lNaOH溶液,定容时俯视刻度线,所得溶液的物质的量浓度______0.1mol/l
④用中和滴定法测某NaOH溶液的浓度,量取待测液未用该溶液润洗滴定管,测得的溶液的浓度______实际浓度
Ⅱ、氧化还原反应中实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:
2
+10H++8e-→N2O+5H2O
Fe(SO4)3、KMnO4、Na2CO3、FeSO4四种物质中的一种物质能使上述还原过程发生.
(1)写出该氧化还原反应的方程式(不配平):______.
(2)该反应中氧化剂和还原剂物质的量之比为______.
(3)反应中硝酸体现了______、______性质.
(4)反应中若产生0.1mol气体,则转移电子的物质的量是______.
参考答案:Ⅰ、(1)①用pH试纸测定Na2CO3溶液的pH时,需要用玻璃棒蘸取一定的液体,故①正确;
②配制一定物质的量浓度的氯化钠溶液,需要用玻璃棒搅拌和引流,故②正确;
③将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体,不能用玻璃棒搅拌,否则得不到胶体,会使胶体聚沉,故③错误;
④探究Ba(OH)2?8H2O晶体和NH4Cl晶体反应过程中的能量变化是为了保证二者充分及时的反应完全,需要搅拌,故④正确;
⑤实验室用新制备的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀,不能用玻璃棒搅拌,故⑤错误;
故答案为:③⑤;
(2)①读量筒中液体的体积时,视线偏高,读取的体积数大于实际体积数,故答案为:大于;
②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,称得的质量为9.6g,故答案为:小于;
③配制500ml?0.1mol/lNaOH溶液,定容时俯视刻度线,溶液的体积偏小,根据C=nV可知,溶液的体积偏小,浓度偏大,故答案为:大于;
④用中和滴定法测某NaOH溶液的浓度,量取待测液未用该溶液润洗滴定管,使的待测液的浓度变稀,一定体积的溶液中含有的溶质的物质的量偏少,消耗的标准液体积偏小,待测液的浓度偏小,故答案为:小于;
Ⅱ、(1)Fe2(SO4)3、KMnO4、Na2CO3中Fe、Mn、C三种元素都处在最高价,则具有氧化性,只有FeSO4中Fe处在较低价,则具有还原性,在NO3-+4H++3e→NO+2H2O中发生的氧化剂被还原的反应,则该氧化还原反应为:
FeSO4+HNO3→N2O+Fe2(SO4)3+Fe(NO3)3+H2O;
故答案为:FeSO4+HNO3→N2O+Fe2(SO4)3+Fe(NO3)3+H2O;
(2)因HNO3中N元素的化合价降低,是氧化剂,一个HNO3化合价降低4;FeSO4中Fe元素的化合价升高,是还原剂,一个FeSO4化合价升高1,根据化合价升降总数相等,氧化剂和还原剂物质的量之比1:4,故答案为:1:4;
(3)因硝酸中的N元素的化合价为+5价,N2O中N元素的化合价为+1价,在该反应中N元素的化合价降低,则体现硝酸的氧化性,而硝酸盐与硝酸中N元素的化合价相同,则体现硝酸具有酸性,故答案为:氧化性;酸性;
(4)因硝酸中的N元素的化合价为+5价,N2O中N元素的化合价为+1价,所以生成一个N2O转移的电子数为2(5-1)=8,则产生0.1mol气体转移电子的物质的量是0.8mol,故答案为:0.8mol.
本题解析:
本题难度:一般
2、选择题 分类是学习和研究化学的一种常用科学方法,下列分类合理的是( )
A.根据反应是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
B.根据是否含氧元素来确定物质是否为氧化物
C.根据元素原子最外层电子数的多少将元素为金属元素和非金属元素
D.根据在水溶液或熔融状态下能否导电,将化合物分为电解质和非电解
参考答案:A.氧化还原反应的实质为电子的转移,则根据反应是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应,故A正确;
B.氧化物中只有两种元素,则含氧元素的物质不一定为氧化物,如氯酸钾,故B错误;
C.根据元素的名称确定金属元素与非金属元素,则不能根据元素原子最外层电子数的多少将元素为金属元素和非金属元素,如H最外层电子数为1,属于非金属元素,故C错误;
D.根据在化合物在水溶液或熔融状态下能否导电可将化合物分为电解质与非电解质,故D正确;
故选AD.
本题解析:
本题难度:一般
3、选择题 亚硝酸(HNO2)既可以做氧化剂又可作还原剂,当它在反应中作氧化剂时,可能生成的物质是( )
A.N2
B.N2O3
C.HNO3
D.NO2
参考答案:亚硝酸中N元素的化合价为+3价,当它在反应中作氧化剂时,N元素的化合价降低,
则可能生成的物质是N2,而选项BCD中N元素的化合价均≥3,
故选:A.
本题解析:
本题难度:简单
4、填空题 用“双线桥”分析下列氧化还原反应的电子转移方向及数目,并指出相关物质.
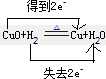
(1)CuO+H2?
Cu+H2O? ?还原剂______,氧化产物______,______;
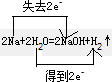
(2)2Na+2H2O=2NaOH+H2↑? 氧化剂______,还原产物______,______.
参考答案:(1)CuO+H2??△?.?Cu+H2O中,H元素的化合价升高,H2为还原剂,H2O为氧化产物,“双线桥”表示电子转移方向及数目为
,
故答案为:H2;H2O;

;
(2)2Na+2H2O=2NaOH+H2↑中,H元素的化合价降低,H2O为氧化剂,H2为还原产物,“双线桥”表示电子转移方向及数目为
,
故答案为:H2O;H2;

.
本题解析:
本题难度:简单
5、选择题 下列叙述中正确的是( )
A.化合反应不一定都属于非氧化还原反应
B.阳离子只有氧化性,阴离子只有还原性
C.在氧化还原反应中,肯定是一种元素被氧化,另一种元素被还原
D.含氧酸能起氧化作用,无氧酸则不能
参考答案:A、当发生化合反应时,如元素的化合价发生变化,则属于氧化还原反应,如不变化,则不属于氧化还原反应,例如H2+Cl2=2HCl属于氧化还原反应,CaO+H2O=Ca(OH)2属于非氧化还原反应,故A正确;
B、亚铁离子具有还原性,高锰酸根离子具有氧化性,故B错误;
C、氧化还原反应中,同种元素之间可发生氧化还原反应,如Cl2+H2O=HCl+HClO,化合价发生变化的只有Cl元素,故C错误;
D、含氧酸和无氧酸中都含有H+,具有氧化性,故D错误.
故选A.
本题解析:
本题难度:简单