微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 卤族元素的单质和化合物很多。
(1)卤素原子与氢原子形成的共价键中,极性最强键的是_____。NaF、MgF2、SiF4三种晶体的熔点从高到低的顺序是______。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl? B.CsICl2=CsI+Cl2
(3)CH3Cl、BF3、SCl2三种分子中属于极性分子的是?,ClO2-中心氯原子的杂化轨道类型为______,写出一种与SO32-互为等电子体的分子?。
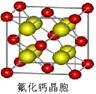
(4)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻最近的?两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
参考答案:(1)H-F(1分) MgF2﹥NaF﹥SiF4 (2分)
(2)A?(2分)
(3)CH3Cl、SCl2(2分)? sp3杂化(2分)? PCl3(或NCl3等)(2分)
(4)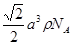 ?(2分)
?(2分)
本题解析:(1)由于形成共用电子对的两元素的非金属性强弱相差越大,形成的共价键的极性越强;卤素原子与氢原子形成的共价键中,都含有氢原子,其它元素的非金属性大小关系为:F>Cl>Br>I,所以极性键的极性大小关系为:H-F>H-Cl>H-Br>H-I;NaF MgF2为离子晶体所以熔点高于分子晶体SiF4,在离子晶体中,离子的半径越小,晶格能越大;阴、阳离子所带电荷越多,晶格能越大,则晶体的熔点越高;电荷的影响大于半径的影响,所以NaF、MgF2、SiF4三种晶体的熔点从高到低的顺序是MgF2﹥NaF﹥SiF4。
(2)加热多卤化物则离解为简单的卤化物和卤素单质。CsBr3=CsBr+Br2,若为多种卤素的多卤化物,则离解生成具有最高晶格能的一种卤化物,如:CsICl2=CsCl+ICl,而不是CsI+Cl2,所以选A。
(3)组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子,所以BF3属于非极性分子,SCl2属于极性分子,CH3Cl空间结构为四面体形,不是正四面体,正负电荷的中心不重合,属于极性分子。ClO2-中价层电子对个数=2+1/2(7+1-2×2)=2,且含有2个孤电子对,所以空间构型是V型,sp3杂化;等电子体是指具有相同电子数目和原子数目的分子或离子,SO32-中有4个原子,6+6×3+2=26个价电子。
(4)该晶胞中含有钙离子个数=1/8×8+6×1/3 =4,氟离子个数=8,,相邻最近的两个Ca2+的核间距是正方体对角线的一半,所以正方体的边长为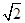 a cm,ρ=
a cm,ρ=  ?,所以CaF2的相对分子质量可以表示为
?,所以CaF2的相对分子质量可以表示为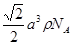 。
。
本题难度:一般
2、填空题 已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
⑴Y、Z、W元素的第一电离能由大到小的顺序是 ? 。
⑵K的二价离子电子排布式是 ? 。
⑶Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ? ;Y、Z的这些氢化物的沸点相差较大的主要原因是 ? 。
⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ? ;1 mol该分子中含有 σ键的数目是 ? 。
⑸Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ? ,Z原子的配位数是 ? 。
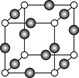
参考答案:⑴N>O>C?⑵[Ar] 3d9?⑶C2H6氮的氢化物(N2H4)分子间存在氢键?
⑷sp2? 4NA?⑸Cu3N ?6
本题解析:根据题意可知这几种元素分别是:X是H;Y是C;Z是N;W是O;K是Cu。⑴一般情况下,同一周期的元素,元素的非金属性越强,其失去电子越难,即第一电离能就越大。但是由于N原子的电子处于半充满的稳定状态,所以失去电子比O还难,因此C、N、O元素的第一电离能由大到小的顺序是N>O>C。⑵29号元素Cu的二价离子电子排布式是[Ar] 3d9。(3)具有18个电子的碳元素的氢化物的化学物质为C2H6。具有18个电子的氮元素的氢化物的化学物质为N2H4。C2H6、N2H4的沸点相差较大是因为在乙烷C2H6的分子间只有分子间作用力,而在联氨N2H4的分子间除了有分子间作用力外,还存在氢键。增加了分子之间的相互作用。⑷若H、O、C形成的某化合物呈酸性,相对分子质量为46的物质为甲酸HCOOH。该化合物分子中Y原子轨道的杂化类型sp2杂化。在1 mol该分子中含有 σ键的数目是4NA。⑸在该晶胞中含有的N原子个数为:8×1/8="1;" 含有的Cu原子个数为:12×1/4=3.所以该晶体的化学式为Cu3N。在晶体中与N原子距离相等且最近的Cu原子个数为6,它们分别在N原子的上、下、前、后、左、右六个方向。因此N原子的配位数是6。
本题难度:一般
3、选择题 使用微波炉加热,具有使受热物质均匀受热、表里一致、速度快、热效率高等优点。其工作原理是通电后炉内的微波场以几亿赫兹的高频改变外电场的方向,水分子因而能迅速摆动,产生热效应,这是因为
[? ]
A.水分子具有极性共价键
B.水分子中有共用电子对
C.水由氢、氧两元素组成
D.水分子是极性分子
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列有关物质组成与结构表示方法不正确的是( )
A.HClO?电子式:

B.CH4?比例模型:

C.乙炔结构简式:HC≡CH
D.质子数55,中子数82的原子
Cs
参考答案:A
本题解析:
本题难度:一般
5、选择题 下列有关化学键与晶体结构说法正确的是
[? ]
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
参考答案:D
本题解析:
本题难度:简单