微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列分子结构中,有原子的最外层电子不能满足8电子稳定结构的是?(? )
A.N2
B.PCl3
C.XeF2
D.CO2
参考答案:C
本题解析:只要化合物中元素化合价的绝对值和该元素最外层电子数之和满足8,就可以说明该原子满足最外层8电子稳定结构。据此可知,选项B、D正确,C中Xe是稀有气体,不满足8电子稳定结构。A中氮气是单质,氮原子满足8单质稳定结构,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题灵活性强,侧重对学生答题能力的培养,有助于调动学生的学习兴趣和学习积极性。该题的关键是理解核外电子的排布规律,然后结合题意具体问题、具体分析即可。
本题难度:简单
2、选择题 下列说法正确的是( )
A.非金属原子间以共价键结合的物质都是共价化合物
B.1mol氢氧化钡与足量盐酸发生中和反应生成水时所释放的热量称为中和热
C.原电池工作时电流从正极流向负极
D.凡是能电离出离子的化合物都是离子化合物
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列说法正确的是( )
①水银不是银②干冰不是冰③铅笔不含铅④金刚石不含金.
A.①④
B.②
C.②③
D.①②③④
参考答案:D
本题解析:
本题难度:简单
4、填空题 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
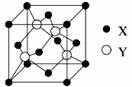
①在1个晶胞中,X离子的数目为?。
②该化合物的化学式为?。若其晶胞边长为540.0pm,则密度为?,X与最近的Y之间的距离为?
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是?。
(3)Y 与Z 可形成YZ42-
①YZ42-的空间构型为?(用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式:?。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为?。
参考答案:(1)①4?②ZnS?;4.1g/cm3; ?(2)sp3
?(2)sp3
(3)①正四面体?②CCl4或SiCl4等?(4)16NA或16×6. 02×1023个
本题解析:元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,所以X是Zn。元素Y基态原子的3p 轨道上有4个电子,则Y应该是S元素。元素Z 的原子最外层电子数是其内层的3倍,则Z是氧元素。
(1)①根据晶胞结构冰依据均摊法可知,在1个晶胞中,X离子的数目为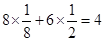 个。
个。
②同样计算可知,含有Y的数目也4个,所以该化合物的化学式为ZnS。根据晶胞的结构可知,若其晶胞边长为540.0pm,则密度=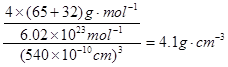 。根据晶胞的结构可知,S原子周围的4个锌原子构成正四面体型结构,则X与最近的Y之间的距离为
。根据晶胞的结构可知,S原子周围的4个锌原子构成正四面体型结构,则X与最近的Y之间的距离为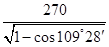 或
或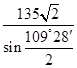 或
或 。
。
(2)H2S是V形结构,则S原子是sp3杂化。
(3)①在SO42-中中心原子S原子含有的孤对电子对数=(6+2-4×2)÷2=0,所以YZ42-的空间构型为正四面体。
②原子数和价电子数分别都相等的是等电子体,则和SO42-互为等电子体的可以是CCl4或SiCl4等。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,由于1个氨气分子中含有3个σ键,另外又形成形成4个配位健,则含有的σ键数目是3×4+4=16,所以1mol该配合物中含有σ键的数目为16NA或16×6. 02×1023个
点评:该题是中等难度试题的考查,也是高考中的常见题型。试题综合性强,贴近高考,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力以及空间的想象能力。有助于提升学生的学科素养,提高学生的应试能力。该题的难点是晶体的有关计算,所以熟练掌握好均摊法。
本题难度:困难
5、填空题 【物质结构与性质】
M是原子序数<30的一种金属,常用于航空、宇航、电器及仪表等工业部门,M原子的最外层有空轨道,且有两个能级处于电子半充满状态。
(1)M原子的外围电子排布式为__________,在周期表中属于?区元素。
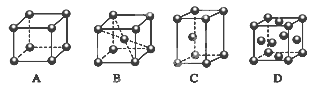
(2)M的堆积方式属于钾型,其晶胞示意图为______(填序号)。
(3)MCl3·6H2O有三种不同颜色的异构体
A、[M(H2O)6]Cl3?B、[M(H2O)5Cl]Cl2·H2O和C、[M(H2O)4Cl2]Cl·2H2O。为测定蒸发MCl3溶液析出的暗绿色晶体是哪种异构体,取0.010 mol MCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g。该异构体为?(填A或B或C)。
(4)MO2Cl2常温下为暗红色液体,熔点-96.5℃,沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①固态MO2Cl2属于________晶体;
②CS2中碳原子和丙酮(CH3COCH3)羰基中的碳原子分别采取的杂化方式为____杂化和________杂化。
(5)+3价M的配合物K[M(C2O4)2(H2O)2]中,配体是______,与C2O42-互为等电子体的分子是(填化学式)__________。
参考答案:(1)3d54s1?d
(2)B
(3)B
(4)①分子?②sp、sp2
(5)C2O42-、H2O;N2O4
本题解析:(1)M原子的最外层有空轨道,且有两个能级处于电子半充满状态,说明M为Cr,Cr原子的外围电子排布式为3d54s1;在元素周期表位于d区。
(2)Cr的堆积方式属于钾型,K为体心立方堆积,故B型正确。
(3)取0.010 mol MCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g,沉淀为AgCl,所以Cl?的物质的量为2.870g÷143.5g/mol=0.2mol,说明1mol该物质含有2mol Cl?,故B项正确。
(4)①MO2Cl2常温下为暗红色液体,熔点-96.5℃,沸点117℃,熔沸点较低,所以固态MO2Cl2属于分子晶体。
②CS2的结构类似于CO2,所以CS2中碳原子的杂化方式为sp杂化;丙酮(CH3COCH3)羰基中的碳原?形成了3个σ键,无孤对电子,所以为sp2杂化。
(5)根据配合物K[M(C2O4)2(H2O)2]可知配体为:C2O42-、H2O;C2O42-含有46个电子,所以与N2O4互为等电子体。
本题难度:一般