微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 元素X原子的最外层有6个电子,元素Y原子的最外层有3个电子,这两种元素形成的化合物的化学式可能是
[? ]
A.XY2
B.X2Y
C.Y3X2
D.Y2X3
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列分子的结构中,原子的最外层电子不能都满足8电子稳定结构的是
[? ]
A.CO2
B.PCl3
C.CCl4
D.NO2
参考答案:D
本题解析:
本题难度:简单
3、填空题 [物质结构与性质]碳是形成化合物种类最多的元素。
(1)CH2=CH—C≡N是制备腈纶的原料,其分子中σ键和π键的个数之比为________(填最简整数比),写出该分子中所有碳原子的杂化方式:________________。
(2)乙醇(CH3CH2OH)和二甲醚(CH3OCH3)的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是_______________________________。
(3)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为________________。
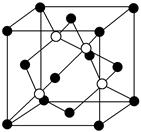
(4)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。如图所示为碳化硅的晶胞(其中 为碳原子,
为碳原子, 为硅原子)。每个碳原子周围与其距离最近的硅原子有________个。设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为________(用含a、b的式子表示)。
为硅原子)。每个碳原子周围与其距离最近的硅原子有________个。设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为________(用含a、b的式子表示)。
参考答案:(1)2∶1 sp2、sp (2)乙醇分子之间形成氢键
(3)3d84s2 (4)4 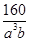
本题解析:(1)凡单键均为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,故CH2=CH—C≡N中含有6个σ键,3个π键,故σ键和π键的个数之比为2∶1。分子中所有碳原子的价电子均参与形成了共价键,第一个和第二个碳原子有3个σ键,采取sp2杂化,而第三个碳原子只有2个σ键,采取sp杂化。
(2)乙醇分子之间可形成氢键,故其沸点较高。
(3)基态碳原子的未成对电子数为2个,故第四周期第Ⅷ族元素的基态原子有2个未成对电子,其基态价层电子排布式为3d84s2。
(4)由题意碳化硅的结构与金刚石类似,则每个碳原子周围与其距离最近的硅原子应为4个。每个晶胞含有碳原子和硅原子各4个,故每个晶胞的质量为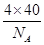 g,每个晶胞的体积为a3 cm3,则
g,每个晶胞的体积为a3 cm3,则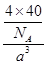 =b g·cm-3,可得NA=
=b g·cm-3,可得NA=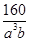
本题难度:一般
4、选择题 下列有关化学键的说法正确的是
[? ]
A.化学键是相邻原子或离子间的相互作用,它存在于分子、原子团等中 ?
B.离子键是阴、阳离子通过静电作用而形成的化学键? ?
C.共价键只存在于共价化合物中?
D.非金属元素的原子之间不可能形成离子键
参考答案:AB
本题解析:
本题难度:简单
5、填空题 海水中富含氯元素。
(1) KCl广泛应用于医药和农业,KCl晶体中Cl-的电子排布式为_____________________。
(2)下表是部分金属元素的电离能:
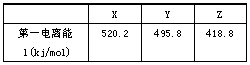
已知X、Y、Z的价层电子排布均为ns1,则三种金属的氯化物(RCI)的熔点由高到低的顺序为____________________。
(3)RC1用作有机合成催化剂,并用于颜料、防腐等工业。R+中所有电子正好充满K、L、M三个电子层,它与Cl 形成的晶体结构如下图所示。R的元素符号是__________,与同一个Cl-相连的R+有_________个。

(4)卤代烃在有机合成中作用巨大,烃基的结构对卤代烃的活性有很大的影响。CH3-CH2C1和碱溶液容易发生取代反应,而CH2=CH-C1和碱溶液不发生反应,请从结构上解释其差异___________________。
(5)HCl和HF结构相似,由于氢键的存在使两者性质上存在较大差异,请列举出由于氢键的影响导致的性质差异___________________________________。
参考答案:(1)1s22s22p63s23p6
(2)ZCl YCl
YCl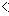 XCl
XCl
(3)Cu;4
(4)CH3-CH2-Cl中与Cl原子成键的C采取sp3杂化,而CH2=CH-Cl中与Cl原子成键的C采取sp2杂化,电子云密度不同;CH3-CH2-Cl中的C-Cl键的键长比CH2=CH-Cl中C-Cl键的键长要长;CH2=CH-Cl 中的π键对Cl的作用力比CH3-CH2-Cl中的C-Cσ键强
(5)HF的沸点比HCl高;氢氟酸是弱酸,盐酸足强酸;实验测得HF的相对分子质量偏大
本题解析:
本题难度:一般