微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列试剂应该保存在棕色试剂瓶中的是
A.碳酸氢铵
B.氯化亚铁溶液
C.浓硝酸
D.漂白粉
参考答案:C
本题解析:分析:见光易分解的药品要保存在棕色试剂瓶中,易分解的物质要阴暗处保存,易和空气中成分发生化学反应的物质要密封保存.
解答:A、温度高时,碳酸氢铵易分解,所以要存放在阴暗处保存,故A错误;
B、氯化亚铁易被空气中氧气氧化而变质,所以要密封保存,故B错误;
C、浓硝酸见光易分解生成二氧化氮、水和氧气,所以要保存在棕色试剂瓶中,故C正确;
D、漂白粉易和二氧化碳反应而变质,所以要密封保存,故D错误;
故选C.
点评:本题考查化学试剂的保存,题目难度不大,注意化学试剂的保存与化 学试剂的性质有关.
本题难度:一般
2、选择题 3.6g碳在一定量的氧气中燃烧,反应后生成的气体质量为9.6g。则在标准状况下,生成物CO和CO2的体积比为
A.3:2
B.4:1
C.3:1
D.7:4
参考答案:C
本题解析:设CO和CO2的物质的量分别是x和y。3.6g碳是0.3mol,所以由x+y=0.3和28x+44y=9.6,解得x=0.225,y=0.075,所以二者的体积之比是3:1,答案选C。
本题难度:一般
3、选择题 下列各组变化中,ΔH或Q前者小于后者的一组是?
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1;? CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)=2H2O(l) ΔH1;? H2(g)+O2(g)=H2O(l) ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g) ΔH1? CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
A.①②③
B.②④
C.②③④
D.③④
参考答案:A
本题解析:明确:ΔH有正负之分,而Q均取正值
A项:均为甲烷的燃烧,前者生成的水为液态,放出的热量多,故ΔH1相对小
B项:前者是后者反应热的两倍,故ΔH1相对小
C项:2SO2+O2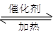 2SO3是气体系数减小的可逆反应,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中进行反应,由于气体的总物质的量减小,等容环境中体系压强逐渐减小,而等压环境相当于增压,反应物的转化率相对大,放出的热量相对多,故Q1相对较小
2SO3是气体系数减小的可逆反应,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中进行反应,由于气体的总物质的量减小,等容环境中体系压强逐渐减小,而等压环境相当于增压,反应物的转化率相对大,放出的热量相对多,故Q1相对较小
④前者为吸热反应,后者为放热反应,故ΔH2相对小
故答案为A
本题难度:简单
4、填空题 我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C===K2S+N2↑ +3CO2↑。该反应的还原剂是 ,氧化剂是 。
参考答案: C , S、KNO3 。
本题解析:在氧化还原反应中,元素化合价降低的物质做氧化剂,元素化合价升高的物质做还原剂,从方程式中看出,S的化合价从0变为-2价,S做氧化剂,KNO3中的N的合价从+5价降低到0价,KNO3做氧化剂,C从0价升高到+4价,C做还原剂,所以还原剂有C,氧化剂有S、KNO3。
考点:氧化还原反应的基本概念。
本题难度:一般
5、选择题 下列变化须加入还原剂才能实现的是
A.P→P2O5
B.Fe3O4→Fe
C.Na2SO4→BaSO4
D.Mg→MgSO4