微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法或表示方法正确的是
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石) ΔH=1.9kJ/mol”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,若将含1molCH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=—285.8kJ/mol
参考答案:C
本题解析:A、硫蒸气比硫固体的能量高,因此若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量少,错误;B、能量越低,物质越稳定,错误;C、醋酸的电离子要吸收一部分热量,正确;D、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=—571.6kJ/mol,错误。
本题难度:一般
2、填空题 根据下列叙述写出相应的热化学方程式:
(1)已知常温常压下,0.5molCH4在O2中完全燃烧,放出445.16kJ的热量,写出表示CH4的燃烧热的热化学方程式:______.
(2)已知16g固体硫完全燃烧时放出148.4kJ的热量,该反应的热化学方程式是:______.
(3)右图是198K时N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式为:______.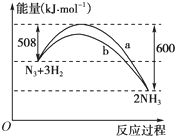
参考答案:(1)0.5molCH4在O2中完全燃烧,放出445.16kJ的热量,即1molCH4在氧气中燃烧生成CO2和液态水,放出889.32kJ热量,
则热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.32?kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.32?kJ/mol;
(2)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kj热量,则热化学方程式为:S(s)+O2(g)=SO2(g);△H=-296.8?kJ/mol,故答案为:S(s)+O2(g)=SO2(g);△H=-296.8?kJ/mol;
(3)该反应放出的能量大于吸收的能量,所以放热,△H=放出的能量-吸收的能量=600kJ/mol-508kJ/mol=92kJ/mol,该反应的热化学方程式为:N2(s)+3H2(g)=2NH3(g);△H=-92?kJ/mol,
故答案为:N2(s)+3H2(g)=2NH3(g);△H=-92?kJ/mol;
本题解析:
本题难度:一般
3、填空题 (14分)(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇。
已知某些化学键的键能数据如下表:
化学键
| C—C
| C—H
| H—H
| C—O
| C≡O
| H—O
|
键能/kJ·mol-1
| 348
| 413
| 436
| 358
| 1072
| 463
|
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为?
?;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min
| 0
| 5
| 10
| 15
| 20
| 25
|
压强/MPa
| 12.6
| 10.8
| 9.5
| 8.7
| 8.4
| 8.4
|
则从反应开始到20min时,以CO表示的平均反应速率=?,该温度下平衡常数K=?,若升高温度则K值?(填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是?;
A.2 v (H2)正=" v" (CH3OH)逆?
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变?
D.单位时间内生成 n molCO 的同时生成 2n molH2
(Ⅱ)回答下列问题:
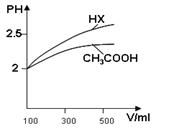
(1)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO?)-c(Na+)=_________mol·L-1(填精确值)。
参考答案:
Ⅰ(1)CO(g)+2H2(g)  ?CH3OH(g)?△H=" -116" KJ/mol?
?CH3OH(g)?△H=" -116" KJ/mol?
(2)0.0125mol/(L·min);? 4 (mol/L)-2;?减小。
(3)B C
Ⅱ(1)> ;?(2)9.9×10-7 。
本题解析:Ⅰ(1)CO(g)+2H2(g)  ?CH3OH(g)?△H=" -116" KJ/mol?
?CH3OH(g)?△H=" -116" KJ/mol?
(2)? CO(g)? +? 2H2(g)? ?CH3OH(g)
?CH3OH(g)
起始:? 1 mol? 2 mol? 0 mol
变化:? x mol? 2x mol? x mol
平衡:(1-x)mol? 2(1-x)mol? x mol
依题意有以下关系式:(依据物质的量之比等于压强之比)

 ? x=0.5
? x=0.5
所以从反应开始到20min时,以CO表示的平均反应速率:v(CO)=
 0.0125mol/(L·min);?平衡常数:k=
0.0125mol/(L·min);?平衡常数:k=
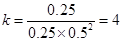 ?
?
由第一小题可知该反应为放热反应,当升高温度时,平衡向着热的方向,也就是逆向移动,因此平衡常数的数值减小。
(3)A.错误,正确的应该为: v (H2)正 =" 2" v (CH3OH)逆 ; B.因为正向是气体物质的量减小的方向,而反应前后气体总的质量是不变的,只要是正向移动,混合气体的摩尔质量就会增大,反应就会减小,因此,容器内气体的平均摩尔质量保持不变时,一定是化学反应达到平衡状态之时,正确;C.同理,容器中气体的压强保持不变时,也是达到平衡状态之时;D.单位时间内生成 n molCO 的同时生成 2n molH2,这个关系式是永远存在的。因此选:B C
Ⅱ(1)从图中可以看出,加入相同量的水,HX的PH值变化大一点,也即HX这种酸酸性强一点,Ka(HX)>Ka(CH3COOH);?
(2)依据电荷守恒,有以下关系式:c(CH3COO?)+c(OH-)=c(Na+)+c(H+)
所以有:c(CH3COO?)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7
本题难度:一般
4、填空题 (9分)某温度下,在2L容器中3种物质间进行反应, X、Y、Z的物质的量随时间的变化曲线如图。反应在t1min时到达平衡,依图所示:
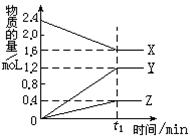
⑴①该反应的化学方程式是_____________________。
②在t1min时,该反应达到了__________状态,下列可作
为判断反应已达到该状态的是________?__(填序号)。
A.X、Y、Z的反应速率相等
B.X、Y的物质的量浓度不再改变
C.生成3molY的同时生成1molZ
D.生成1molZ的同时生成2molX