微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法:强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
干法:Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
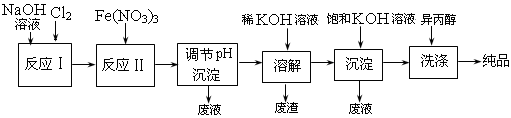
①反应I的化学方程式为 ? 。
②反应II的离子方程式为 ? 。
③加入饱和KOH溶液的目的是 ? 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ? ;? ______?____。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
参考答案:(1)①2NaOH + Cl2=NaCl + NaClO + H2O
②3ClO-+ 10OH-+ 2Fe3+=2FeO42-+ 3Cl-+ 5H2O
③增大K+ 浓度,促进K2FeO4晶体析出
(2)高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3胶体有吸附性,可将杂质一起凝聚而沉降?(3)3∶1
本题解析:(1)①氯气溶解在氢氧化钠溶液中,生成氯化钠和次氯酸钠,反应式为2NaOH + Cl2=NaCl + NaClO + H2O。
②次氯酸钠具有氧化性,能把硝酸铁氧化生成高铁酸盐,而次氯酸钠被还原生成氯化钠,反应式为3ClO-+ 10OH-+ 2Fe3+=2FeO42-+ 3Cl-+ 5H2O。
③加入饱和氢氧化钾溶液,能增大钾离子浓度,促使K2FeO4晶体析出。
(2)高铁酸钾具有强氧化性,能杀菌消毒,还原产物是铁离子。而铁离子能水解生成氢氧化铁胶体,吸附溶液中的杂质形成沉淀而析出。
(3)1mol氯气在反应中只能得到1mol电子,生成次氯酸钠。而1mol硝酸铁能失去3mol电子,所以氧化剂和还原剂的物质的量之比是3︰1。
本题难度:一般
2、填空题 (20分)工业上用铬铁矿(主要成分FeO·Cr2O3,杂质为SiO2、Al2O3等)
生产重铬酸钾(化学式K2Cr2O7,)的流程如下:
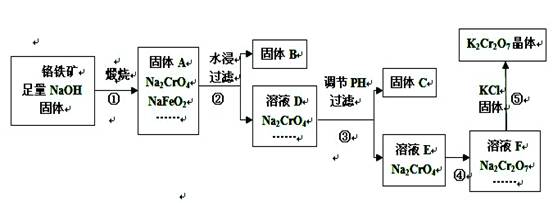
(1)固体A中,除Na2CrO4、NaFeO2、NaOH外还有?等;
(2)固体A水浸时,NaFeO2会发生强烈水解产生固体B,其化学反应方程
式为?;
(3)固体C中含有2种物质,要先加入下列物质中的?,然后才
能进行过滤分离。
A.氢氧化钠溶液?B.稀氨水?C.稀盐酸
(4)步骤④加入盐酸得到的溶液F中,除Na2 Cr2O7外,还含有的溶质
是?;
(5)在上述流程中,有氧化还原反应发生的是第____步。
(6)已知20℃时K2Cr2O7饱和溶液浓度为0.4 mol·L-1,步骤⑤中加入固
体氯化钾,若使K+离子浓度达到4 mol·L-1(保持温度20℃),则溶液F中Cr2O72-离子的浓度最大为?。
参考答案:(1)Na2SiO3、Na[Al(OH)4 ](4分)
(2)NaFeO2 + 2H2O =" NaOH" + Fe(OH)3(3分)
(3)C (3分)(4)NaCl(3分)(5)①(3分)(6)0.016 mol·L-1(4分)
本题解析:(1)铬铁矿中含有杂质SiO2、Al2O3所以当与固体氢氧化钠煅烧时会产生Na2SiO3和Na[Al(OH)4 ]两种物质
(2) NaFeO2会发生强烈水解产生固体B,水解的过程中没有化合价的变化,根据NaFeO2可以判断产物是Fe(OH)3,所以水解方程式为:
NaFeO2 + 2H2O =" NaOH" + Fe(OH)3
(3)固体C中含有2种物质是Al(OH)3和H2SiO3,Al(OH)3溶于盐酸,而H2SiO3不溶于盐酸,所以可以用盐酸将二者分开。
(4)由于加入盐酸得到的溶液F,所以F中肯定含有氯离子,再加上溶液中本来含有的钠离子,所以溶液中还含有的溶质是NaCl,
(5)铬铁矿中铬为+3价,与氢氧化钠煅烧后变为+6价,化合价发生变化,其他过程中均没有化合价的变化,所以上述流程中只有①是氧化还原反应。
(6)饱和溶液中的K2Cr2O7浓度为0.4 mol·L-1则可以知道,饱和溶液中C(K+)="0.8" mol·L-1,C(Cr2O72-)="0.4" mol·L-1,所以饱和时可以仿照沉淀溶解平衡计算溶液中的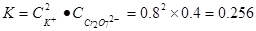 ,由于在同一温度下,所以K相同,根据K+离子浓度可以计算出Cr2O72-浓度的最大值,
,由于在同一温度下,所以K相同,根据K+离子浓度可以计算出Cr2O72-浓度的最大值,
本题难度:一般
3、填空题 ( 14 分)在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍―镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下:
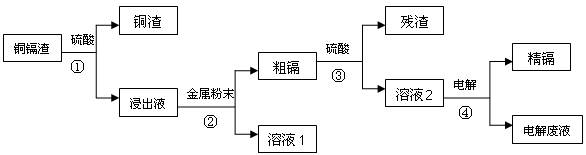 请回答下列问题:
请回答下列问题:
(1)镉元素位于周期表中第?周期,第?族,其原子结构示意图为?;
(2)写出步骤①反应的离子方程式??。
(3)步骤②所加入的金属是?。
(4)步骤④用“溶液2”作电解液,镉在?极析出,该电极材料是
(5)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠,沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝,沉淀镉离子。写出硫化钠沉淀镉离子的离子方程式?。
参考答案:
(14分)(1)五,ⅡB,
(2)Cd+2H+=Cd2++H2↑,Zn+2H+=Zn2++H2↑
(3)锌?(4)阴、镉?(5)Cd2++S2-=CdS↓
本题解析:略
本题难度:简单
4、选择题 合金是一类用途广泛的金属材料。下列物质中,不属于合金的是?
[? ]
A.碳素钢
B.黄铜
C.硬铝
D.水银
参考答案:D
本题解析:
本题难度:简单
5、填空题 透闪石为硅酸盐,化学式是Ca2Mg5Si8O22(OH)2,改写成氧化物形式为______.
参考答案:硅酸盐改写成氧化物形式时:活泼的金属氧化物写在前面,再写SiO2,含有氢元素的H2O最后写,Ca2Mg5Si8O22(OH)2可表示为2CaO?5MgO?8SiO2?H2O,
故答案为:2CaO?5MgO?8SiO2?H2O.
本题解析:
本题难度:简单