微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物.各种生成物在平衡体系内的分压与反应温度的关系如图所示(己知气体的分压之比等于物质的量之比).
(1)420K时,发生反应的化学方程式为:______;若反应中消耗l?mol?Xe,则转移电子______mol.
(2)600~800K时,会发生反应:XeF6(g)?

XeF4(g)+F2(g),
其反应热△H______0(填“>”“=”或“<”).理由是______.
(3)900K时,容器中存在的组分有______.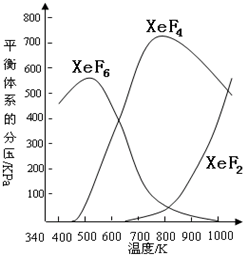
参考答案:(1)在420K时,产物只有XeF6,故其反应方程式为:Xe+3F2=XeF6,XeF6中Xe的化合价为+6价,则反应中消耗l?mol?Xe,则转移电子6mol,
故答案为:Xe+3F2=XeF6;6;
(2)在600K~800K时随着温度的升高,XeF6的分压减小,XeF4的分压增大,即平衡正向移动,故正向为吸热反应,△H>0,
故答案为:>;随着温度的升高,XeF6(g)

XeF4(g)+F2(g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的△H>0;
(3)在900K时XeF2、XeF4、XeF6共存,根据可逆反应的特点,还应有XeF2存在着,
故答案为:XeF6、XeF4、XeF2、Xe、F2.
本题解析:
本题难度:一般
2、简答题 发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值.下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:
(1)该过程中产生的CO可继续与水蒸气发生可逆反应得到CO2和H2,此反应的平衡常数表达式K=______.
(2)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式______.
(3)“催化还原”反应制乙二醇原理如下:CH3OOC-COOCH3(g)+4H2(g)?HOCH2-CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究.如图表示乙二醇达到平衡时的产率随原料投料比[n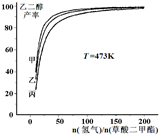 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=______.
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=______.
(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
①草酸氢钾溶液中存在如下平衡:H2O?H++OH-、HC2O4-?H++C2O42-和______.
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______(填序号).
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.c(Na+)=c(H2C2O4)+c(C2O42-)d.c(K+)>c(Na+)
(5)以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为______;若以甲烷代替该燃料电池中的甲醇,向外界提供相等电量,则每代替32g甲醇,所需标准状况下的甲烷的体积为______L.
参考答案:(1)CO(g)+H2O(g)?CO2(g)+H2(g)的化学平衡常数K=c(CO2)×c(H2)c(CO)×c(H2O),
故答案为:c(CO2)×c(H2)c(CO)×c(H2O);
(2)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,则CH3OH(l)的燃烧热为677kJ/mol-27kJ/mol=650kJ/mol,故CH3OH(l)完全燃烧的热化学方程式为:
CH3OH(l)+3/32O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol
故答案为:CH3OH(l)+3/32O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol;
(3)由图象可知,曲线甲表示的乙二醇的产率最大,原料投料比[n(氢气)/n(草酸二甲酯)]一定时,由方程式可知,正反应是体积减小的反应,增大压强平衡向正反应移动,平衡时乙二醇的产率增大,故曲线甲对应的压强是P(甲)=3.5MPa,
故答案为:3.5MPa;
(4)①H2C2O4为二元中强酸,HC2O4-在溶液中发生电离与水解,还存在平衡:HC2O4-+H2O?H2C2O4+OH-,
故答案为:HC2O4-+H2O?H2C2O4+OH-;
②a.碳元素在溶液中存在形式有:HC2O4-、H2C2O4、C2O42-,根据物料守恒由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),故a正确;
b.根据电荷守恒有:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),故c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-),故b错误;
c.由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)、c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)可知,
c(Na+)=c(C2O42-)-c(H2C2O4),故c错误;
d.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些,故c(K+)>c(Na+),故d正确;
故答案为:ad;
(5)总反应式为2CH3OH+3O2(g)=2CO2(g)+4H2O,正极是还原反应,氧气在正极放电,酸性条件下获得电子生成水,正极电极反应式为:3O2+12H++12e-=6H2O,总反应式减去正极反应式可得负极电极反应式为:2CH3OH+2H2O-12e-=2CO2+12H+,即CH3OH+H2O-6e-=CO2+6H+,
32g甲醇的物质的量为为32g32g/mol=1mol,完全燃烧转移电子数为1mol×6=6mol,故需要甲烷的物质的量为6mol8=0.75mol,需要甲烷的体积为0.75mol×22.4L/mol=16.8L,
故答案为:CH3OH+H2O-6e-=CO2+6H+;16.8.
本题解析:
本题难度:一般
3、选择题 对可逆反应A(g)+B(g)?C(g)(正反应为吸热反应),下列图象正确的是( )
A.

B.

C.
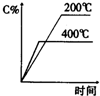
D.

参考答案:D
本题解析:
本题难度:一般
4、选择题 一定温度下将1mol?SO3?放入2L的反应器内,当反应:2SO3(g)

2SO2(g)+O2(g)?平衡时,容器内有0.6molSO2,其平衡常数约是( )
A.0.68
B.0.34
C.0.45
D.0.47
参考答案:B
本题解析:
本题难度:一般
5、选择题 将固体NH4I置于密闭容器中,在一定温度下发生下列反应: ①NH4I(s) NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)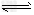 H2(g)+I2(g) 达到平衡时,c(H2)=0.5?mol/L,c(HI)=4?mol/L,则此温度下反应①的平衡常数为
H2(g)+I2(g) 达到平衡时,c(H2)=0.5?mol/L,c(HI)=4?mol/L,则此温度下反应①的平衡常数为
A.9?
B.16
C.20?
D.25
参考答案:C
本题解析:
本题难度:一般