微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 最新研发的波音787客机具有更省油、更舒适的特点,波音787还是首款使用碳纤维复合材料超过50%的客机,开创了在航空领域复合材料大范围代替传统金属材料的新时代.如图所示的某聚酰胺树脂是波音飞机材料中的一种,具有较好的导热性、耐水性.下列说法正确的是( )
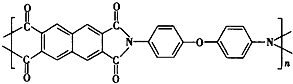
A.碳纤维复合材料中,碳纤维是增强材料,该树脂是基体材料
B.复合材料是未来材料发展的趋势,因此应该停止对金属材料的研究
C.该树脂中所有原子共平面
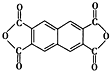
D.该树脂可以由单体
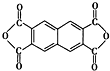
和
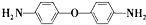
通过加聚反应得到
参考答案:A.碳纤维复合材料是以树脂作为基体材料,碳纤维作增强材料,故A正确;
B.不可能停止金属材料的研究,故B错误;
C.该聚酰胺树脂分子中的N原子与周围的原子成三角锥构型,故C错误;
D.该树脂可以由单体
和
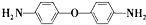
通过缩聚反应得到,故D错误.
故选A.
本题解析:
本题难度:简单
2、选择题 属于有机高分子材料的是( )
A.铝合金
B.聚乙烯保鲜膜
C.玻璃
D.陶瓷
参考答案:A.铝合金属合金,是金属材料,故A错误;
B.聚乙烯保鲜膜属于有机合成高分子材料,故B正确;
C.玻璃属于硅酸盐产品,属无机非金属材料,故C错误;
D.陶瓷和玻璃一样,属无机非金属材料,故D错误.
故选B.
本题解析:
本题难度:一般
3、选择题 属于天然高分子的是( )
A.蛋白质
B.聚氯乙烯
C.乙酸乙酯
D.油脂
参考答案:A
本题解析:
本题难度:一般
4、填空题 (12分)盐酸西替利嗪在临床上广泛用于呼吸系统、皮肤和眼部过敏性疾病,它的一种合成路线如下:
 (1)上述反应中,属于取代反应的是? ▲?(填序号).
(1)上述反应中,属于取代反应的是? ▲?(填序号).
(2)物质M核磁共振氢谱有? ▲?个峰。
(3)盐酸西替利嗪中含氧官能团是? ▲?(写名称)。
(4)反应④中会产生一种含氮副产物,最有可能是? ▲?。
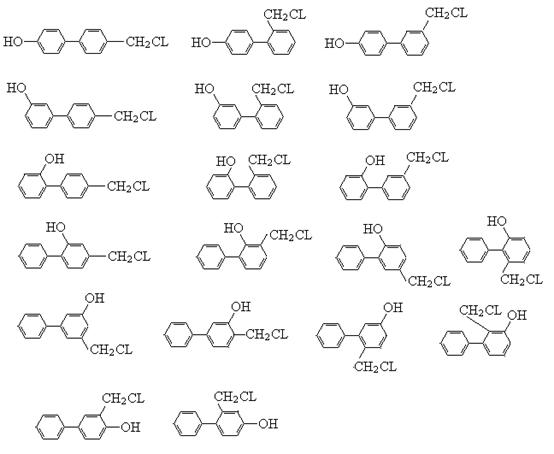
(5)图中物质N符合下列条件的异构体有? ▲?种。
①能与氯化铁溶液发生显色反应?②含有-CH2Cl?③含有联苯(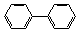 )结构。
)结构。
(6)抗血栓药氯吡格雷的手性合成如下:

已知X的分子式为:C9H8Cl2O2,则X的结构式为? ▲?。氯吡格雷中手性碳原子数目为?▲?个。
(7)已知:?
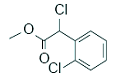
试以中药材大青叶的提取物 ?(紫苏醛)和甲醇为原料合成(紫苏
?(紫苏醛)和甲醇为原料合成(紫苏
酸甲酯)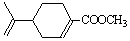 试写出合成路线。合成路线流程图示例如下:
试写出合成路线。合成路线流程图示例如下:
参考答案:(1)①③④⑤⑥
(2)5
(3)羧基;醚键
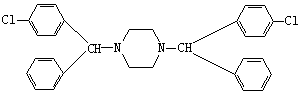
(4)
(5)19
(6) ?1
?1
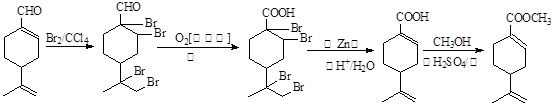
(7)
(第5小题2分;第7题4分,每个步骤1分;其他每空1分;共12分)
本题解析:(1)①③④⑤⑥属于取代反应,②属于加成反应;
(2)M的结构简式如图所示: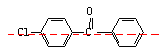 ,其结构属于对称结构,所以,其核磁共振氢谱图中有5组峰。
,其结构属于对称结构,所以,其核磁共振氢谱图中有5组峰。
(3)盐酸西替利嗪的结构简式为 ,其含氧官能团有:羧基;醚键
,其含氧官能团有:羧基;醚键
(4)反应④的副产物为: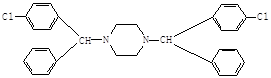
(5)19种,如下图所示
(6)X的结构式为
(7)结合信息可得如下流程图:

本题难度:一般
5、填空题 [化学一选修2:化学与技术](15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水的处理主要包括水的净
化、污水处理、硬水软化和海水的淡化等。
(1)海水的淡化常用的方法有_________、_________、电渗析法等。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。
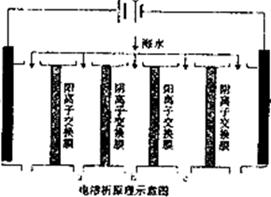
①阳极(惰性电极)的电极反应式为 __________________.
②淡水的出口为a、b、c中的_________ 出口。
③某出口排出的浓海水中溴元素的含量为0.68g/L,现用氯气将其中的溴离子氧化为溴单质,则处理l.0×10 L该浓海水需标况下的氯气的体积为_________
L该浓海水需标况下的氯气的体积为_________ 。
。
(3) K2FeO4是自来水厂常用的消毒、净化剂。工业上常用Fe(NO3)3溶液与浓KCIO溶液在强碱性环境中生成K2FeO4,该反应的离子方程式为___________________________.
(4)氯碱工业常用_________(填“阴”或“阳”)离子交换膜电解槽电解精制的饱和食盐水,?若食盐水中含有杂质MgCl2则会对离子交换膜电解槽造成损害,其原因是_______ (用离子方程式表示)。
(5)工程塑料ABS合成时,用了以下三种单体: 、
、
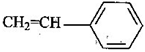 ,请写出ABS的结构简式_______________________________。
,请写出ABS的结构简式_______________________________。
参考答案:(1)蒸馏法(1分) 离子交换法 (1分)
(2)① 4OH― -4e-?= 2H2O+O2 ↑ (2分)
② b? (2分)?
③ 9.52? (2分)
(3)2 Fe3+ + 3 ClO― + 10 OH― ="2" FeO42- + 3 Cl― + 5 H2O (2分)
(4)阳?(1分);
Mg2+ + 2Cl― + 2H2O? ?Cl2 ↑+ H2 ↑ + Mg(OH)2 ↓ (2分)
?Cl2 ↑+ H2 ↑ + Mg(OH)2 ↓ (2分)
(5) 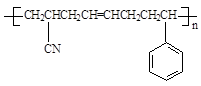 ?(2分)
?(2分)
本题解析:(1)海水的淡化常用的方法有蒸馏法、离子交换法、电渗析法等;
(2)①阳极是阴离子放电,所以阳极是氢氧根离子放电生成氧气,电极反应式为4OH― -4e-?= 2H2O+O2 ↑②在电场作用下,海水的阳离子趋向阴极,阴离子趋向阳极,但阳离子只能透过阳膜,却被相邻的阴膜阻挡,阴离子与此相反,所以淡水从b口出;
③l.0×10 L该浓海水中含有溴元素的物质的量是l.0×10
L该浓海水中含有溴元素的物质的量是l.0×10 L×0.68g/L÷80g/mol,需要氯气标准状况下的体积是l.0×10
L×0.68g/L÷80g/mol,需要氯气标准状况下的体积是l.0×10 L×0.68g/L÷80g/mol÷2×22.4L/mol=9520L=9.52m3;
L×0.68g/L÷80g/mol÷2×22.4L/mol=9520L=9.52m3;
(3)根据氧化还原反应理论,Fe(NO3)3溶液与浓KClO溶液在强碱性中生成K2FeO4及氯化钾、水,离子方程式为2 Fe3+ + 3 ClO― + 10 OH― ="2" FeO42- + 3 Cl― + 5 H2O;
(4)氯碱工业常用阳离子交换膜电解槽电解精制的饱和食盐水,若盐水中含有杂质MgCl2,镁离子通过阳离子交换膜与阴极的氢氧根离子结合生成氢氧化镁沉淀堵塞离子交换膜,发生的离子方程式为? Mg2++2Cl―+2H2O Cl2↑+ H2↑+Mg(OH)2↓
Cl2↑+ H2↑+Mg(OH)2↓
(5)CH2=CH-CN与苯乙烯中含有1个碳碳双键,而1,3-丁二烯中含有2个碳碳双键,所以三者发生加聚反应时1,3-丁二烯中的碳碳双键断裂分别与CH2=CH-CN与苯乙烯中碳碳双键发生加成聚合反应,所以?产物的结构简式为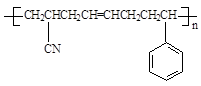
本题难度:一般