微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,在一体积恒定容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和容积不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是(?)
2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和容积不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是(?)
A.均减半? B.均加倍? C.均增加1 mol? D.均减少1 mol
2、选择题 在一定条件下,已达平衡的可逆反应:2A(g)+B(g)  ?2C(g),下列说法中正确的是?(?)
?2C(g),下列说法中正确的是?(?)
A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=
B.改变条件后,该反应的平衡常数K一定不变
C.如果改变压强并加入催化剂,平衡常数会随之变化
D.若平衡时增加A和B的浓度,则平衡常数会减小
3、选择题 在2A+B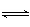 3C+4D反应中,表示该反应速率最快的是?
3C+4D反应中,表示该反应速率最快的是?
[? ]
A.υ(A)=?0.5?mol?/(L·s)?
B.υ(B)=?0.3?mol?/(L·min)
C.υ(C)=?0.8?mol?/(L·s)?
D.υ(D)=?1?mol?/(L·s)
4、选择题 将4molA气体和2molB气体置于2L的密闭容器中,混合后发生如下反应: 2A(g) + B(g) == 2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是
[? ]
A.用物质A表示的反应速率为0.6mol/(L·s)
B.用物质B表示的反应速率为0.3mol/(L·s)
C.2s时物质A的转化率为30%
D.2s时物质B的浓度为0.3mol/L
5、填空题 氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源。目前分解水制氢气的工业制法之一是“硫—碘循环”,主要涉及下列反应:
Ⅰ? SO2+2H2O+I2= H2SO4+2HI Ⅱ? 2HI H2+I2
H2+I2
Ⅲ? 2H2SO4= 2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是?。
a.反应Ⅲ易在常温下进行? b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O? d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0—2min内的平均反应速率v(HI)=? ?。该温度下,反应2HI(g) H2(g)+I2(g)的平衡常数K=?。相同温度下 ,若开始加入HI(g)的物质的量是原来的2倍,则?是原来的2倍。
H2(g)+I2(g)的平衡常数K=?。相同温度下 ,若开始加入HI(g)的物质的量是原来的2倍,则?是原来的2倍。

a.平衡常数? b.HI的平衡浓度?
c.达到平衡的时间? d.平衡时H2的体积分数
(3)SO2在一定条件下可被氧化生成SO3,其反应为:2SO2 (g) + O2(g)  2SO3(g)?△H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
2SO3(g)?△H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。

①a电极的电极反应式为?;
②若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为?。?
(4)实际生产还可以用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入10 mol/L的硫酸溶液的体积范围为?。