| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《氯及其化合物》试题强化练习(2017年最新版)(六)
参考答案:C 本题解析:升温时,Cl2的溶解度迅速变小,溶液中c(H+)变小,A错;SO2与氯水发生反应:Cl2+SO2+2H2O=H2SO4+2HCl,溶液中c(H+)变大,B错;降温,Cl2的溶解度迅速变大,继续通入Cl2时,溶液中c(H+)增大,C正确;pH=7时,c(H+)=c(OH-) ,根据电荷守恒可得,c(Na+)=c(Cl-)+c(ClO-),故c(Na+)>c(Cl-),c(Na+)>c(ClO-),由于HClO不完全电离,故c(Cl-)>c(ClO-),D错 本题难度:一般 2、实验题 下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放 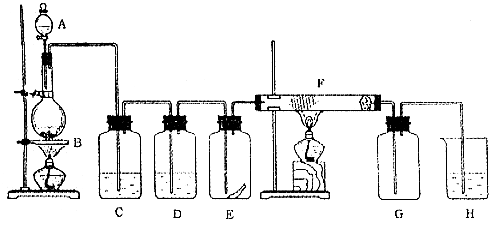 试回答: 试回答:(1)仪器A的名称叫?,烧瓶B中反应的化学方程式为_____________?, (2)C中试剂是?;D中试剂的作用是?; (3)E中现象是?; F中反应的化学方程式是?, (4)H中发生反应的化学方程式为?。 参考答案:(1)分液漏斗? MnO2+4HCl(浓) 本题解析:根据题中所给出的信息可知本实验是室制取纯净、干燥的Cl2,并进行检验Cl2性质实验。 本题难度:一般 3、选择题 下列各组化合物中,均能由单质直接化合而得到的是 参考答案:C 本题解析:CuS、SO3、FeCl2不能由单质直接化合。 本题难度:简单 4、填空题 (4分)(1)写出电解饱和食盐水的 参考答案: 本题解析:略 本题难度:简单 5、简答题 探究氯气的性质时,将干燥的有色布条和湿润的有色布条分别放入两个集气瓶中,同时通入氯气后,可观察到的现象为______,该实验中起漂白作用的物质为______,在常温下,将氯气通入氢氧化钠溶液中可以得到漂白液(有效成分为NaClO),其反应的化学方程式为______. 参考答案:干燥的氯气不具有漂白性,不能使有色布条褪色,但氯气和水能反应生成盐酸和次氯酸,次氯酸有漂白性,可使有色布条褪色,氯气通入氢氧化钠溶液中生成氯化钠、次氯酸钠和水,反应的方程式为2NaOH+Cl2=NaClO+NaCl+H2O, 本题解析: 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《反应速率与.. | |