微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)工业上制造普通玻璃的原料是______、______、______.
(2)高岭石的组成为Al2(Si2O5)(OH)4,若改用氧化物的形式表示其组成为______.
参考答案:(1)工业用纯碱、石灰石和石英为原料制备玻璃,故答案为:纯碱;石灰石;石英;
(2)Al2(Si2O5)(OH)4改用氧化物的形式表示其组成为Al2O3?2SiO2?2H2O,故答案为:Al2O3?2SiO2?2H2O.
本题解析:
本题难度:一般
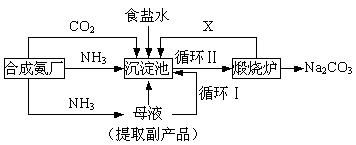
2、实验题 (16分)我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
 ?
?
沉淀池中四种盐在不同温度下的溶解度(g / 100 g水)表

| 0℃
| 10℃
| 20℃
| 30℃
| 40℃
| 50℃
| 60℃
| 100℃
|
NaCl
| 35.7
| 35.8
| 36.0
| 36.3
| 36.6
| 37.0
| 37.3
| 39.8
|
NH4HCO3
| 11.9
| 15.8
| 21.0
| 27.0
| -①
| -
| -
| -
|
NaHCO3
| 6.9
| 8.1
| 9.6
| 11.1
| 12.7
| 14.5
| 16.4
| -
|
NH4Cl
| 29.4
| 33.3
| 37.2
| 41.4
| 45.8
| 50.4
| 55.3
| 77.3
|
①>35℃NH4HCO3会有分解
请回答:
(1)沉淀池中反应温度控制在30℃~35℃,是因为若高于35℃,则?,若低于30℃,则?;为控制此温度范围,采取的加热方法为?。
(2) 沉淀池中发生的化学反应方程式是?。
(3)副产品的一种用途为?,写出上述流程中X物质的分子式?。
(4)加料完毕后,继续保温30分钟,目的是?。静置后只析出NaHCO3晶体的原因是?。用蒸馏水洗涤NaHCO3晶体的目的是除去?杂质(以化学式表示)。
(5) 为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加?。
参考答案:(1)NH4HCO3分解; 反应速率降低; 水浴加热(共3分)
(2) NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓
或NH3+CO2+H2O=NH4HCO3?NH4HCO3+NaCl=NaHCO3↓+NH4Cl(3分)
(3) 化肥或电解液或焊药等(其他合理答案均给分)(1分)CO2(1分)
(4)使反应充分进行;(2分) NaHCO3的溶解度最小;(2分) NaCl、NH4Cl、NH4HCO3(3分)
(5) 稀硝酸和硝酸银溶液(1分)
本题解析:略
本题难度:一般
3、填空题 (15分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) 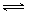 ?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1
?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温
B.采用高压
C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) 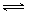 ?H2NCOONH4(氨基甲酸铵) (l)?△H1
?H2NCOONH4(氨基甲酸铵) (l)?△H1
第二步:H2NCOONH4(l) 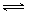 ?H2O(l)+H2NCONH2(l)?△H2
?H2O(l)+H2NCONH2(l)?△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
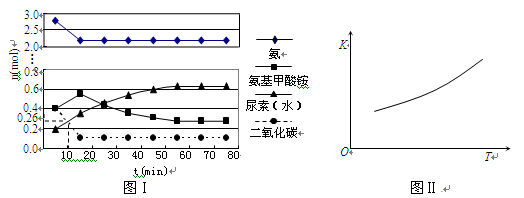
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________________。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2__________0(填“>”“<”或“=”)
参考答案:15分)⑴B?
⑵①2? 55?②0.148 mol/(L·min)? ③>
(每空3分,共15分)
本题解析:(1)由方程式2NH3(l)+CO2(g) 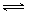 ?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1,可知正反应方向为气体体积减少的方向,在高压条件下,平衡将正反应方向移动,从而提高尿素的产率
?H2O(l)+H2NCONH2 (l)? △H=-103.7 kJ·mol-1,可知正反应方向为气体体积减少的方向,在高压条件下,平衡将正反应方向移动,从而提高尿素的产率
(2)①合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) 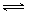 ?H2NCOONH4(氨基甲酸铵) (l)?△H1
?H2NCOONH4(氨基甲酸铵) (l)?△H1
第二步:H2NCOONH4(l) 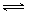 ?H2O(l)+H2NCONH2(l)?△H2;
?H2O(l)+H2NCONH2(l)?△H2;
从图形分析,第一步反应达平衡时时间更短,第二步反应达平衡时间更长,所以,合成尿素总反应的快慢由第二步决定;总反应进行到55min时到达平衡。
②v(CO2)=0.148 mol/(L·min);
③由图II可得,△H2>0;
本题难度:一般
4、选择题 要检验市售的金制首饰是否用纯金制成,方法之一是将饰品浸入某溶液中,过一段时间取出后称量质量是否变化即作出判断,该溶液是(?)
A.盐酸
B.硫酸
C.硝酸
D.王水
参考答案:C
本题解析:盐酸和硫酸与不活泼金属如铜等不反应,所以它们无法检验出金制首饰是否用纯金制成;而王水的氧化性太强,它可以融化金,所以也不能用来检验。只有C选项最恰当。
本题难度:简单
5、选择题 下列金属一般用电解熔融盐的方法冶炼的是( )。
A.活动性强的金属
B.活动性弱的金属
C.人类较早使用的金属
D.明代作货币的金属
参考答案:A
本题解析:金属活动性强的金属如Na、K、Mg、Ca等,一般用电解熔融盐的方法冶炼。
本题难度:一般