微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)某液体化合物X2Y4,常用做火箭燃料。16g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)===X2(g)+2Y2O(l)。冷却后标准状况下测得生成物的体积为11.2 L,其密度为1.25g/L,则:
(1)反应前O2的体积V(O2)为________。
(2)X2的摩尔质量为________;Y元素的名称是________。
(3)若反应生成0.1mol X2,则转移电子的物质的量为________mol。
参考答案:(1)11.2L;(2)28g/mol;氢元素;(3)0.4。
本题解析:根据题意知,X元素形成的气体单质标准状况下的密度为1.25g/L,X2的摩尔质量为1.25g/L×22.4L/mol=28g/mol则反应后的气体为N2,11.2L氮气的物质的量为0.5mol。(1)由反应方程式知,N2和氧气的物质的量之比为1:1,所以生成N2的体积等于氧气的体积为11.2L;(2)X元素形成的气体单质标准状况下的密度为1.25g/L,X2的摩尔质量为1.25g/L×22.4L/mol=28g/mol;根据氮气和N2Y4的关系式知,反应N2Y4的物质的量为0.5mol,则M(N2Y4)=32g/mol,N元素的相对原子质量是14,所以Y的相对原子质量是1,为氢元素;(3)N元素的化合价由-2价变为0价,所以若反应生成0.1mol X2,则转移电子的物质的量=0.1mol×2×(2-0)=0.4mol。
考点:考查根据化学方程式计算。
本题难度:一般
2、选择题 设NA表示阿伏加德罗常数,下列叙述不正确的是?(?)
A.常温常压下,NA个CO2分子的质量总和为44 g
B.常温常压下,1mol氦气含有的氦原子为1 NA
C.12.4 g 白磷(P4)中含有的磷原子数为0.4 NA
D.0.1 mol·L-1稀硫酸100 mL中含硫酸根个数为0.1 NA
参考答案:D
本题解析:A、NA个CO2分子的物质的量为1mol,故其质量为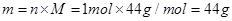 。
。
B、氦气的化学式为Ne,为单原子分子。故1mol氦气所含有的氦原子为1NA。
C、12.4 g 白磷(P4)的物质的量为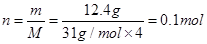 ,因此所含有的磷原子数为0.4NA。
,因此所含有的磷原子数为0.4NA。
D、100 mL0.1 mol·L-1的稀硫酸的物质的量为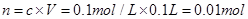 ,故其硫酸根离子个数为0.01NA。
,故其硫酸根离子个数为0.01NA。
点评:本题考查了化学计量的相关计算,属于基础题。熟练掌握化学计量的相关计算公式,是解答此类题型的关键。课本中出现的公式有: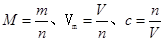
本题难度:一般
3、计算题 (6分)含CuSO4和H2SO4的混合溶液200mL,其中CuSO4物质的量浓度为1mol.L-1, H2SO4物质的量浓度为0.5mol.L-1,若用此溶液配成0.2mol.L-1 CuSO4和2mol.L-1 H2SO4的混合溶液,试求:
(1)所得溶液的体积是多少毫升?
(2)需加入密度为1.84g.cm-3、98%的浓硫酸多少毫升?
参考答案:(1)1000ml (2)103.3ml
本题解析: (1)稀释前后,硫酸铜的物质的量不变,则所得溶液的体积=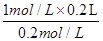 =1000mL,
=1000mL,
答:所得溶液的体积是1000ml;
(2)浓硫酸的物质的量浓度=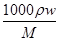 =
=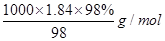 =18.4mol/L,
=18.4mol/L,
增加的硫酸的物质的量=2mol/L×1L-0.5mol/L×0.2L=1.9mol,则需要浓硫酸的体积=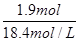 =
=
103.3ml,
考点: 溶液的混合时物质的量浓度的计算。
本题难度:一般
4、选择题 用NA代表阿伏加德罗常数,下列说法中正确的是
A.18g水所含 电子数为NA
电子数为NA
B.8g氦气所含分子数为NA
C.3.2g氧气所含氧原子数为0.1NA
D.24g镁变成镁离子时失去的电子数为2 NA
参考答案:D
本题解析:略
本题难度:一般
5、计算题 将1.95gNa2SO4和Na2CO3的混合物溶于水得溶液A,在A中加入足量未知浓度的BaCl2溶液10.0mL,然后过滤得沉淀B;向B中加入足量稀盐酸,充分反应后剩余沉淀2.33g。计算:(1)原混合物中碳酸钠的质量分数;
(2)标况下,生成气体多少毫升;
(3)氯化钡溶液的物质的量的浓度。
参考答案:(1)27.18%?(2)112ml?(3)1.5mol/L
本题解析:略
本题难度:简单