微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 原电池的反应原理是( )
A.储存电能
B.氧化还原反应
C.化合价升降
D.化学能转化为热能
参考答案:原电池可将化学能转变为电能,反应原理为氧化还原反应,工作时,负极发生氧化反应,正极发生还原反应.
故选B.
本题解析:
本题难度:简单
2、填空题 在25℃时,用石墨电极电解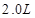 ,
,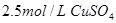 溶液,如有
溶液,如有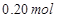 电子发生转移,试回答下列问题:
电子发生转移,试回答下列问题:
(1)阴极发生??反应,电极反应为??。
(2)阳极发生??反应,电极反应为??。
(3)电解后得到的 的质量是??,得到
的质量是??,得到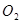 的体积(标准状况)是??。
的体积(标准状况)是??。
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差??,电解液的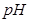 ??(填“变小”、“变大”或“不变”)
??(填“变小”、“变大”或“不变”)
参考答案:(1)还原? Cu2++2e-=Cu?(2)氧化? 4OH--4e-=2H2O+O2↑
(3)6.4g? 1.12L?(4)12.8g?不变
本题解析:(1)惰性电极电解硫酸铜溶液,阴极发生还原反应,则溶液中的铜离子在阴极得到电子而析出,电极反应式是Cu2++2e-=Cu。
(2)惰性电极电解硫酸铜溶液,阳极失去电子,发生氧化反应。则溶液中的OH-放电生成氧气,电极反应式是4OH--4e-=2H2O+O2↑。
(3)反应中注意0.20mol电子,则根据反应式Cu2++2e-=Cu可知,析出0.10mol铜,质量是6.4g。根据反应式4OH--4e-=2H2O+O2↑可知,生成氧气的物质的量是0.05mol,标准状况下的体积是0.05mol×22.4L/mol=1.12L。
(4)如用等质量的两块铜片代替石墨作电极,则阳极是铜失去电子,质量减少6.4g。阴极是溶液中的铜离子得到电子,析出6.4g铜,所以电解后两铜片的质量相差12.8g,而溶液中的浓度不变,则pH不变。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确电解池的工作原理,并依据电子得失守恒计算,然后结合题意灵活运用即可。有利于培养学生的逻辑推理能力和规范的答题能力。
本题难度:一般
3、选择题 某心脏起搏器的动力来源于Li-SOCl2电池。该电池的总反应可表示为:
4Li+2SOCl2 =" 4LiCl" +S +SO2。下列关于该电池的说法正确的是(?)
A.放电过程中Li+向负极移动
B.该电池的电解质溶液为NaCl水溶液
C.正极电极反应式为: 2SOCl2+4e-= 4Cl— +S +SO2
D.当0.4mol Li完全溶解时,流经电解质溶液的电子个数为2.408×1023
参考答案:C
本题解析:原电池中阳离子向正极移动,A不正确。锂属于活泼金属,易和水反应,不能用水作溶剂,B不正确。正极得到电子,发生还原反应,C正确。负极所失去的电子经导线传递到正极,而不是通过溶液,D不正确。答案选C。
本题难度:一般
4、实验题 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次.假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO32-.
(1)该电池反应的离子方程式为??
(2)甲醇在?极发生反应(填“正”或“负”),电池中放电过程中溶液pH将?(填“下降”、“上升”或“不变”);若有16克甲醇蒸汽被完全氧化产生电能,并利用该过程中释放的电能电解足量的硫酸铜溶液假设能量利用率为80%。则将产生标准状况下氧气?L。
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷代表汽油。该电池的正极反应式为??;
(4)放电时固体电解质里的O2-离子的移动方向是向 极移动(填“正”或“负”)。
参考答案:(1)2CH3OH+3O2+4OH-→2CO32-+6H2O? (2)负、13.44L;(3)O2+4e-=2O2-;(4)负号、
本题解析:(1)该电池的总反应式可由下列二式合并得到:2CH3OH+3O2→2CO2+4H2O,CO2+2OH-=CO32-+H2O。(2)燃料电池中可燃物被氧化作负极,根据得失电子数守恒建立关系式:
2CH3OH~3O2
64g? 67.2L
16g×80%? X=(67.2×16×0.8)/64=13.44L
本题难度:简单
5、填空题 (16分)CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径。
(1)下图是在101 kPa,298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化示意图。
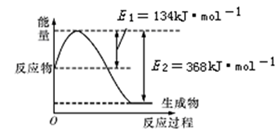
已知:①N2 (g) +O2 (g) =2 NO (g) ΔH=179.5 kJ·mol—1
②2NO (g) +O2 (g) =2 NO2 (g) ΔH=—112.3 kJ·mol—1
请写出NO与CO反应生成无污染气体的热化学方程式:_____________________。
(2)工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=—49.0 kJ·mol—1
CH3OH(g)+H2O(g) ΔH=—49.0 kJ·mol—1
某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。

①该反应在0 ~8 min内CO2的平均反应速率是_____________________;
②该反应的平衡常数表达式为:K=_____________________;
③仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是_____________________,曲线Ⅱ改变的条件可能是____________________。若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是_____________________;
(3)有学者设想以如图所示装置用电化学原理将他们转化为重要化工原料。请回答:
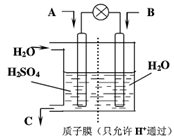
①若A为SO2,B为O2,C为H2SO4,则负极反应式___________________;
②若A为CO2,B为H2,C为CH3OH,则正极反应式__________________。
参考答案:(1)2 NO (g)+2 CO (g)=N2 (g)+2 CO2(g) ΔH=—75 9.8 kJ·mol—1
(2)① 0.125 mol?L—1?min—1 ②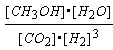
③升温 增压 K1<K2=K
(3)①SO2—2e—+2H2O=4H++SO42— ②CO2+6H++6e—=CH3OH+H2O
本题解析:(1)根据图像得101 kPa,298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO的热化学方程式为③NO2 (g)+ CO(g)="=" CO2(g)+ NO (g) Δ H=—234kJ·mol—1,结合已知:① N2 (g) +O2 (g) =2 NO (g) ΔH=179.5 kJ·mol—1② 2 NO (g) +O2 (g) =2 NO2 (g) ΔH=—112.3 kJ·mol—1,利用盖斯定律:②—①+③×2得NO与CO反应生成无污染气体的热化学方程式:2 NO (g)+2 CO (g)=N2 (g)+2 CO2(g) ΔH =—75 9.8 kJ·mol—1。(2)①根据题给图像知,该反应在0 ~8 min内H2的物质的量变化为6mol,结合反应方程式知CO2的物质的量变化为2mol,容器体积为2L,CO2的浓度变化为1mol/L,根据v=△c/△t计算CO2平均反应速率是0.125 mol?L—1?min—1;②化学平衡常数等于生成物平衡浓度系数次幂的积与反应物平衡浓度系数次幂的积的比值,结合反应方程式写出该反应的平衡常数表达式,见答案;③分析题给图像知,与实线相比,曲线Ⅰ条件下反应达平衡的时间短,反应速率加快,平衡时H2的物质的量较大,说明平衡逆向移动,化学平衡常数减小,K1<K,又该反应为放热反应,故改变的条件可能升温;与实线相比,曲线Ⅱ条件下,反应达平衡的时间缩短,反应速率加快,平衡时氢气的物质的量较小,平衡正向移动,又该反应正反应为气体物质的量减小的反应,故改变的条件可能是加压,温度不变化学平衡常数不变,K=K2则K、K1和K2的大小关系是K1<K2=K;(3)分析题给装置知该装置为原电池。①若A为SO2,B为O2,C为H2SO4,电池反应为2SO2+O2+2H2O H2SO4,负极发生氧化反应,电极反应式为SO2—2e—+2H2O=4H++SO42—;②若A为CO2,B为H2,C为CH3OH,电池反应为CO2+3H2
H2SO4,负极发生氧化反应,电极反应式为SO2—2e—+2H2O=4H++SO42—;②若A为CO2,B为H2,C为CH3OH,电池反应为CO2+3H2 CH3OH+H2O,正极发生还原反应,电极反应式为CO2+6H++6e—=CH3OH+H2O 。
CH3OH+H2O,正极发生还原反应,电极反应式为CO2+6H++6e—=CH3OH+H2O 。
考点:考查热化学方程式的书写、盖斯定律,化学平衡图像分析及原电池原理的应用、电极反应式的书写。
本题难度:困难