微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | L | M | X | R | T
原子半径/nm
0.160
0.143
0.102
0.089
0.074
主要化合价
﹢2
﹢3
﹢6、-2
﹢2
-2
|
A.离子半径大小:r(M3﹢)>r(T2-)
B.R原子失电子的能力弱于L原子
C.X单质可在氧气中燃烧生成XO3
D.L、X形成的简单离子核外电子数相等
参考答案:L和R的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知R为Be,L为Mg;X和T的化合价都有-2价,应为周期表第ⅥA族元素,X的最高价为+6价,应为S元素,T无正价,应为O元素;M的化合价为+3价,应为周期表第ⅢA族元素,根据M原子半径大于X小于L可知应和L同周期,为Al元素.
A.Al3+和O2-具有相同的核外电子排布,原子序数越大,半径越小,则离子半径大小:r(Al3+)<r(O2-),故A错误;
B.Be与Mg处于同一主族,电子层越多,金属性越强,所以Be原子失电子的能力弱于Mg原子,故B正确;
C.S在空气中燃烧只生成SO2,须在催化剂的条件下反应生成SO3,故C错误;
D.Mg2+核外有10个电子,S2-核外有18个电子,二者核外电子数不同,故D错误.
故选:B.
本题解析:
本题难度:简单
2、简答题 短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.
请回答下列问题:
(1)C的最高价氧化物对应水化物电子式为______,其中含有的化学键类型为______.
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为______
(3)用石墨电极电解CD的饱和溶液,若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体的物质的量为______mol.
(4)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是(填序号)______.
①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
(5)25℃时,将pH=4.00的A元素与D元素形成化合物AD的水溶液稀释1.00×103倍,则稀释后溶液中各离子浓度必遵循的定量等式关系式是______.
(6)将一定量的D单质通入一定浓度的苛性钾溶液,两者恰好完全反应(已知反应过程放热),生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是______.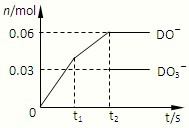
参考答案:短周期元素A、B、C、D原子序数依次增大,B的最外层电子数是次外层的3倍,则B有2个电子层,最外层电子数为6,故B为氧元素;C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子,则C为钠元素;A、C位于同一主族,A为非金属元素,则A为氢元素;B、C的最外层电子数之和与D的最外层电子数相等,则D最外层电子数为7,原子序数比钠元素大,则D为氯元素;E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏,则E为铁元素.
故A为氢元素;B为氧元素;C为钠元素;D为氯元素;E为铁元素.
(1)C为钠元素,最高价氧化物对应水化物为NaOH,由钠离子与氢氧根离子构成,电子式为
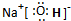
;钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成极性键.
故答案为:
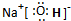
;离子键、极性键.
(2)A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分,则该盐为NaClO,次氯酸钠具有强氧化性,将碘离子氧化物碘单质,反应的离子方程式为 2I-+ClO-+H2O=I2+Cl-+2OH-.
故答案为:2I-+ClO-+H2O=I2+Cl-+2OH-.
(3)用石墨电极电解NaCl的饱和溶液,若反应后溶液的体积为200mL,测得pH为13,则c(OH-)=0.1mol/L,所以n(OH-)=0.2L×0.1mol/L=0.02mol,阳极发生氧化反应,阳极生成氯气,由2Cl-+2H2O?电解?.?2OH-+H2↑+Cl2↑可知,生成氯气0.01mol.
故答案为:0.01.
(4)E元素与D元素可形成ED2和ED3两种化合物分别为FeCl2和FeCl3,
①FeCl2容易被氧化,保存FeCl2溶液时,需向溶液中加入少量Fe单质,防止FeCl2被氧化,故①正确;
②FeCl2可以通过铁与氯化铁反应生成,FeCl3可以通过氯化钡与硫酸铁等反应生成,故②错误;
③铜片、碳棒和FeCl3溶液组成原电池,铜作负极,电子由铜片沿导线流向碳棒,故③正确;
④向淀粉碘化钾溶液滴加几滴ED3的浓溶液,有碘单质生成,碘遇淀粉呈蓝色,苯酚溶液中滴加几滴ED3的浓溶液,原溶液变成紫色,故④错误.
故选:①③.
(5)25℃时,将pH=4.00的HCl的水溶液稀释1.00×103倍,则稀释后溶液中各离子浓度必遵循的定量等式关系式是 电荷守恒,即c(OH-)+c(Cl-)=c(H+).
故选:c(OH-)+c(Cl-)=c(H+).
(6)D为氯元素,将一定量氯气通入一定浓度的苛性钾溶液,两者恰好完全反应(已知反应过程放热),生成物中有三种含D元素的离子,由图可知有ClO-、ClO3-生成,根据电子转移守恒可知还有Cl-生成,容易中n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol+0.03mol×5=0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,所以该苛性钾溶液中KOH的质量是 0.3mol×56g/mol=16.8g.
故答案为:16.8.
本题解析:
本题难度:一般
3、选择题 在学习核外电子排布知识时,甲、乙两小组对多电子原子的能级的有关知识产生了分歧:甲组认为第3周期元素的基态原子中,不可能出现d电子,而乙组认为第3周期元素基态原子中一定有d电子,下列可作为甲组论据的是
[? ]
A.能量最低原理
B.泡利不相容原理
C.洪特规则
D.近似能级图中的顺序,3d轨道能量比4s轨道高
参考答案:A
本题解析:
本题难度:简单
4、选择题 以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
[? ]
A.He
B.
C.1s2
D.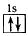
参考答案:D
本题解析:
本题难度:简单
5、选择题 如果发现了原子序数为116的元素,对它的正确叙述是下列组合中的( )
①位于第七周期;②是非金属元素;③最外电子层含有6个电子;
④没有放射性;?⑤属于和氧同族的元素;⑥属于卤素.
A.①③⑤
B.①③⑥
C.②④⑥
D.②③⑤
参考答案:A
本题解析:
本题难度:一般