微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组对比实验,均能观察到左边试管产生气体的速率比右边的快,其中一定能证明Fe3+催化过氧化氢分解的能力强于Cu2+的是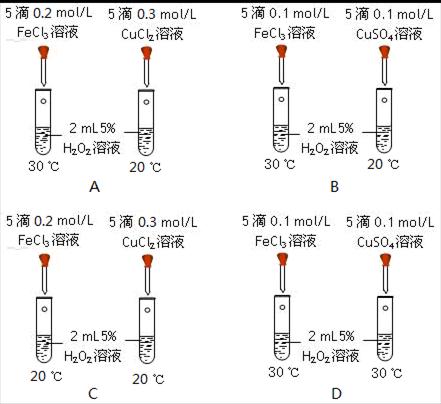
参考答案:C
本题解析:要证明Fe3+催化过氧化氢分解的能力一定强于Cu2+,滴加的量都是相同的,Cu2+的浓度要大于Fe3+的浓度,故选C。
点评:本题以实验的形式考查了氧化性的比较,学生在做本题时要主要比较中要有个条件有差别才能达到效果。
本题难度:简单
2、填空题 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的是?。
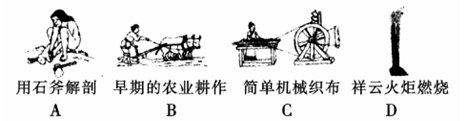
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
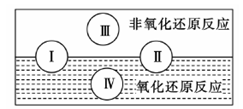
试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式:?。
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是:

①请补充完整,配平方程式并标出电子转移的方向和数目。
②某同学称取了7.9 g KMnO4,固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是?。
③不规范的实验操作会导致实验结果的误差。下列操作会使实验结果偏小的是?(填序号)。
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视容量瓶上的刻度线
C.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
④某同学用上述配好的KMnO4溶液滴定未知浓度的NaNO2溶液:取20 mL未知浓度的NaNO2溶液于锥形瓶;取上述配好的KMnO4溶液于________(填“酸式”或“碱式”)滴定管,滴定完成后消耗KMnO4溶液10 mL,则NaNO2溶液的浓度为________________。
参考答案:(1)D?(2) 2F2 + 2H2O =" 4HF" + O2
(3)①? ?②往容量瓶中加入少量的蒸馏水,盖上瓶塞,看瓶塞处是否漏水,放正,瓶塞旋转180度,重新倒置,看是否漏水?③ABC?④酸式? 0.625mol·L–1
?②往容量瓶中加入少量的蒸馏水,盖上瓶塞,看瓶塞处是否漏水,放正,瓶塞旋转180度,重新倒置,看是否漏水?③ABC?④酸式? 0.625mol·L–1
本题解析:(1)A、B、C都是物理变化,D燃烧是化学反应,且都属于氧化还原反应。(2)四种基本反应类型?中属于氧化还原反应的只有置换反应,水作还原剂,则只能氧元素被氧化,联系氟气与水的反应可写出化学方程式:2F2 + 2H2O =" 4HF" + O2。(3)①反应在酸性溶液中进行,所以方框中应补写H+;Mn的化合价降低5(+7到+2),N元素的化合价升高2(+3到+5),所以MnO4–和Mn2+都配2,NO2–和NO3–都配5,根据电荷守恒,H+配6,根据原子个数守恒H2O配3。②检查容量瓶是否漏水的方法为:往容量瓶中加入少量的蒸馏水,盖上瓶塞,倒置,看瓶塞处是否漏水,正立,瓶塞旋转180度,重新倒置,看是否漏水。③A、少量液体溅出烧杯外,造成溶质的物质的量减小,所配溶液浓度偏小;B、定容时仰视容量瓶上的刻度线,则加水过量,所配溶液浓度偏小;C、“又加入少量水至刻度线”会造成水量增加,溶液浓度偏小。故选ABC。④酸化KMnO4溶液有强氧化性,能氧化橡皮管,所以不用碱式滴定管而用酸式滴定盛装KMnO4溶液;从离子方程式可知KMnO4与NaNO2按2:5的物质的量之比反应,KMnO4的浓度为: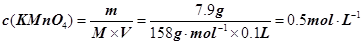 ,则NaNO2溶液的浓度为:
,则NaNO2溶液的浓度为: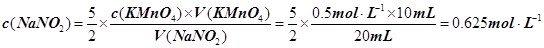 。
。
本题难度:一般
3、填空题 (10分)(1)已知下列变化过程中,0.2 mol R2O72-与0.2 mol K2SO3恰好反应,则R被还原的价态为____。
(2)在100 mL 0.100 mol·L-1的FeBr2溶液中通入Cl2,若要使Fe2+刚好反应完全,则需标准状况下C l2________ mL。
l2________ mL。
(3)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
①已知KBrO3在反应中得到电子,则该反应的还原剂是______________________.
②已知0.2 mol KBrO3在反应中得到1mol电子生成X,则X的化学式为______________.
mol KBrO3在反应中得到1mol电子生成X,则X的化学式为______________.
参考答案:(10分)
(1)? +4(3分)(2) 112(3分)
(3) ① AsH3(2分)②Br2(2分)
本题解析:略
本题难度:一般
4、选择题 在酸性高锰酸钾溶液中加入Na2O2粉末,高锰酸钾溶液褪色,其中发生反应的离子方程
式为:2MnO4- +16H+ + 5Na2O2 ="===" 2Mn2+ +5O2↑ + 8H2O + 10Na+?下列判断正确的是:?
A.高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂
B.反应的氧化产物只有氧气
C.当反应产生标准状况下2.24 L O2时,反应转移的电子为0.1mol
D.向高锰酸钾溶液滴加浓盐酸可以得到酸性高锰酸钾溶液
参考答案:B
本题解析:该反应中高锰酸根中Mn从+7到+2价,做氧化剂,过氧化钠中O从-1价到0价,做还原剂。故A错误,B正确;该反应中转移10个电子,生成5mol氧气,故生成2.24L氧气,转移0.2mol电子,C错误;盐酸具有还原性,高锰酸钾具有强氧化性,不能用于酸化。
本题难度:简单
5、选择题 农药波尔多液可用于水果灭虫,是由石灰水和硫酸铜溶液混合而成的悬浊液。它不能用铁制容器盛放,是因为铁与该农药中的硫酸铜起反应。在该反应中,对铁的叙述错误的是
[? ]
A.铁发生还原反应
B.铁发生氧化反应
C.铁是还原剂
D.铁失去电子
参考答案:A
本题解析:
试题分析:
铁与硫酸铜起反应的方程式为:Fe+CuSO4=FeSO4+Cu
选项A,铁发生氧化反应;
选项B,铁元素化合价升高,发生氧化反应;
选项C,铁元素化合价升高,是还原剂;
选项D,铁化合价升高,失去电子。
故选:A
本题难度:简单