?
参考答案:
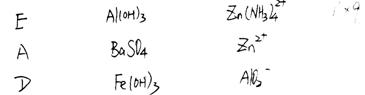
本题解析:略
本题难度:简单
2、选择题 提纯含有少量Ba(NO3)2杂质的KNO3溶液,可使用的方法为
A.加入过量Na2CO3溶液,过滤,除去沉淀,溶液中补加适量HNO3
B.加入过量K2SO4溶液,过滤,除去沉淀,溶液中补加适量HNO3
C.加入过量Na2SO4溶液,过滤,除去沉淀,溶液中补加适量HNO3
D.加入过量K2CO3溶液,过滤,除去沉淀,溶液中补加适量HNO3
参考答案:D
本题解析:由于不能引入新的杂质,所以溶液中的Ba2+用碳酸钾除去,过量的碳酸钾用硝酸酸化除去,答案选D。
点评:该题是基础性试题的考查,难度不大。该类试题需要注意的是在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:简单
3、实验题 碳酸钠—过氧化氢加合物(aNa2CO3·bH2O2)具有漂白、杀菌作用。实验室用“醇析法”制备该物质的实验步骤如下:
第1步:取适量碳酸钠溶解于一定量水里,倒入烧瓶中;再加入少量稳定剂(MgCl2和Na2SiO3),搅拌均匀。
第2步:将适量30%的H2O2溶液在搅拌状态下滴入烧瓶中,于15 ℃左右反应1 h。
第3步:反应完毕后再加入适量无水乙醇,静置、结晶,过滤、干燥得产品。
(1)第1步中,稳定剂与水反应生成两种常见的难溶物,其化学方程式为___________________________________________________________。
(2)第2步中,反应保持为15 ℃左右可采取的措施是_____________________
___________________________________________________。
(3)第3步中,无水乙醇的作用是____________________________________。
(4)H2O2的含量可衡量产品的优劣。现称取m g(约0.5 g)样品,用新煮沸过的蒸馏水配制成250 mL溶液,取25.0 mL于锥形瓶中,先用稀硫酸酸化,再用c mol·L-1 KMnO4溶液滴定至终点。
①配制250 mL溶液所需的玻璃仪器有烧杯、玻璃棒、量筒________、________;
②滴定终点观察到的现象是______________________________________。
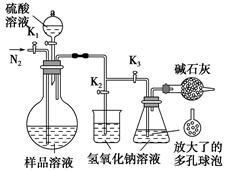
(5)可模拟用蒸馏法测定样品中碳酸钠的含量。装置如右图所示(加热和固定装置已略去),实验步骤如下:
步骤1:按右图所示组装仪器,检查装置气密性。
步骤2:准确量取(4)中所配溶液50 mL于烧瓶中。
步骤3:准确量取40.00 mL约0.2 mol·L-1 NaOH溶液两份,分别注入烧杯和锥形瓶中。
步骤4:打开活塞K1、K2,关闭活塞K3缓缓通入氮气一段时间后,关闭K1、K2,打开K3;经分液漏斗向烧瓶中加入10 mL 3 mol·L-1硫酸溶液。
步骤5:加热至烧瓶中的液体沸腾,蒸馏,并保持一段时间。
步骤6:经K1再缓缓通入氮气一段时间。
步骤7:向锥形瓶中加入酸碱指示剂,用c1 mol·L-1 H2SO4标准溶液滴定至终点,消耗H2SO4标准溶液V1 mL。
步骤8:将实验步骤1~7重复两次。
①步骤3中,准确移取40.00 mL NaOH溶液所需要使用的仪器是________;
②步骤1~7中,确保生成的二氧化碳被氢氧化钠溶液完全吸收的实验步骤是________(填序号);
③为获得样品中碳酸钠的含量,还需补充的实验是______________________。
参考答案:(1)MgCl2+Na2SiO3+2H2O===2NaCl+Mg(OH)2↓+H2SiO3↓ (2)15 ℃水浴或冷水浴 (3)降低过碳酸钠的溶解度(有利于晶体析出)
(4)①250 mL容量瓶 胶头滴管 ②溶液呈粉红色且30 s不褪色
(5)①碱式滴定管 ②1,5,6 ③用H2SO4标准溶液滴定NaOH溶液的浓度
本题解析:(1)由于稳定剂是氯化镁和硅酸钠,由题意混合后生成两种难溶化合物,因此该反应的化学方程式为MgCl2+Na2SiO3+2H2O===Mg(OH)2↓+H2SiO3↓+2NaCl。(2)要想较稳定的保持溶液的温度为15 ℃,较好的方法是用15 ℃的水浴。(3)反应完毕后向溶液中加入无水乙醇,主要作用是降低过碳酸钠的溶解度,有利于其结晶析出。(4)配制250 mL溶液需要的关键仪器是250 mL的容量瓶作为量器,准确确定溶液的体积,还需要烧杯、量筒、玻璃棒、胶头滴管等;由于用酸性高锰酸钾溶液滴定双氧水,因此达到终点时,过量的高锰酸钾可以做指示剂,终点时的现象为滴入最后一滴酸性高锰酸钾溶液颜色呈粉红色,且半分钟不变色。(5)要准确量取40.00 mL NaOH溶液,需要精度高的量器,不能用量筒,应该用碱式滴定管;实验时先通入氮气是为了防止系统中空气的CO2影响实验结果,最后通氮气是为了把生成的CO2全部被烧碱吸收,检查装置气密性是为了防止生成的CO2逸出,加热煮沸烧瓶中的溶液是把生成并溶解在溶液中的CO2赶出然后被烧碱吸收,因此实验步骤1、5、6是为了保证生成的CO2完全被烧碱吸收;由于实验中烧碱溶液的浓度是大约为0.2 mol·L-1,因此要想准确计算实验结果,还需要知道烧碱溶液的准确浓度,这就需要用标准硫酸溶液滴定烧碱溶液的浓度。
本题难度:困难
4、选择题 1molN2和44gCO2的气体体积,前者和后者的关系是
A.大于
B.等于
C.小于
D.不能确定
参考答案:D
本题解析:分析:气体的体积和气体的物质的量的多少以及所处的温度压强有关.
解答:根据物质的量和气体体积的关系公式V=nVm可知,要计算1molN2和44gCO2的气体体积,还须知道二者的Vm的大小,而Vm的大小和气体所处的温度压强有关,故不能确定体积的大小.
故选D.
点评:本题考查学生对公式V=nVm的理解和掌握,考查学生分析和解决问题的能力,难度不大.
本题难度:一般
5、选择题 从海水中可以提取溴,但得到的液溴中常常溶有少量氯气, 除去氯气应该采用的方法是
[? ]
A.加适量的KI溶液
B.通入溴蒸气
C.加入适量的NaOH溶液
D.加入适量的NaBr溶液
参考答案:D
本题解析:
本题难度:一般
|