微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 汽车尾气净化中的一个反应如下:NO(g)+CO(g) 1/2N2(g)+CO2(g) △H=-373.4kJ·mol-1。 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
1/2N2(g)+CO2(g) △H=-373.4kJ·mol-1。 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
[? ]
A.
B.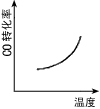
C.
D.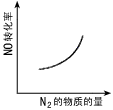
参考答案:C
本题解析:
本题难度:一般
2、填空题 有两只密闭容器A和B,A容器有一个可移动活塞使容器内保持恒压,B容器保持恒容,起始时向两只容器中分别充入等量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等.在保持400℃条件下使之发生反应:2SO2+O2

2SO3?填写下列空白:
(1)达到平衡所需时间A比B______,A中SO2的转化率比B______.
(2)达到(1)所述平衡后,若向两容器通入数量不多的等量氩气,A容器的化学平衡移动,B容器的化学平衡______移动.
(3)达到(1)所述平衡后,向两容器中通入等量的原反应气体,达到平衡后,A中SO3的体积分数______(增大、减小、不变),B容器中SO3的体积分数______.
参考答案:(1)因A容器保持恒压,反应过程中体积变小,浓度增大,根据浓度越大,化学反应速率越快,到达平衡的时间越短,所以达到平衡所需时间A比B短,若A容器保持恒容,两容器建立的平衡等效,而实际上A容器体积减少,压强增大,平衡向正反应方向移动,所以A中SO2的转化率比B大,故答案为:短;大;
(2)平衡后,若向两容器通入数量不多的等量氩气,A容器体积增大,压强不变,参加反应的气体产生的压强减少,平衡向逆反应方向移动,A容器体积不变,压强增大,参加反应的气体产生的压强不变,平衡不移动,故答案为:不;
(3)向两容器中通入等量的原反应气体,达到平衡后,A中建立的平衡与原平衡等效,所以SO3的体积分数不变,B容器中建立的平衡相当于在原平衡的基础上增大压强,平衡正向移动,B容器中SO3的体积分数增大,故答案为:不变;增大.
本题解析:
本题难度:简单
3、简答题 CO和H2可作为能源和化工原料,应用十分广泛.
已知(Ⅰ)CO(g)+2H2(g)=CH3OH(g)△H1=-90.1kJ?mol-1
(Ⅱ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2=-49.0kJ?mol-1
(Ⅲ)CO(g)+H2O(g)=CO2(g)+H2(g)△H3=-41.1kJ?mol-1
(Ⅳ)2CH3OH(g)=CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
回答下列问题:
(1)写出由H2和CO直接制备二甲醚的热化学方程式为______.根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响______.
(2)有研究者在催化剂(含Cu-Zn-Al-O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如图甲所示.其中CO转化率随温度升高而降低的原因是______.
(3)由CO和H2在催化剂作用下,也可以合成甲醇.反应原理为:CO(g)+2H2(g)?CH3OH(g).
①对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则以上反应KP=______;
②在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数(如图乙所示).解析在T1~T2及T4~T5二个温度区间,容器内甲醇的体积分数如图乙所示的变化趋势,其原因是______.
③在不改变反应物用量情况下,将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有(写出2点)______、______.
参考答案:(1)Ⅰ、CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ?mol-1
Ⅳ、2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
依据盖斯定律Ⅰ×2+Ⅳ得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g),△H=-204.7kJ?mol-1;
该反应是气体体积减小的反应,增加压强,平衡正向进行,反应速率加快,CO和H2的转化率增大,CH3OCH3产率增加,
故答案为:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g),△H=-204.7kJ?mol-1;增大压强,化学反应速率增大,平衡正向移动,CO和H2转化率增大,CH3OCH3产率增加;
(2)CO转化率随温度升高而降低,是因为反应是放热反应,升温平衡逆向进行,故答案为:反应放热,温度升高,平衡逆向移动;
(3)①平衡常数指的是:生成物浓度之幂或分压力的乘积与反应物浓度的幂或分压力的乘积之间的比值,故KP=c(CH3OH)c(CO)c2(H2),
故答案为:c(CH3OH)c(CO)c2(H2);
②反应进行到t时刻时,a、b没有达到平衡状态,c、d、e达到平衡状态,故T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以甲醇的体积分数随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以甲醇的体积分数减少,
故答案为:T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以甲醇的体积分数随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以甲醇的体积分数减少;
③将容器c中的平衡状态转变到容器d中的平衡状态,即降低甲醇的含量,使平衡逆向移动,可采取的措施有:升温、减压,
故答案为:升温;降压.
本题解析:
本题难度:一般
4、选择题 反应2A(g)
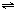
2B(g)+C(g);正反应吸热,达平衡时,要使v正降低、c(A)增大,应采取的措施是( )
A.加压
B.减压
C.减小c(B)
D.降温
参考答案:A.增大压强,平衡向逆反应方向移动,正逆反应速率都增大,故A错误;
B.减小压强,平衡向正反应方向移动,正反应速率减小,c(A)减小,故B错误;
C.减小c(B),平衡向正反应方向移动,c(A)减小,故C错误;
D.降低温度,正逆反应速率都减小,平衡向逆反应方向移动,c(A)增大,故D正确.
故选D.
本题解析:
本题难度:简单
5、选择题 在其它条件一定时,图中曲线表示反应2NO(g)+ O2(g)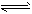 2NO2(g) △H>0达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是
2NO2(g) △H>0达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是
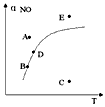
[? ]
A.A或E
B.B点
C.C点
D.D点
参考答案:C
本题解析:
本题难度:一般