微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某新型 “纸”电池以碳纳米管和金属锂作为两极,造纸用的纤维素在一种离子液体X中溶解并做成隔离膜,电池工作时的总反应为:xLi+C(碳纳米管)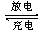 LixC,下列有关说法正确的是
LixC,下列有关说法正确的是
A.放电时Li+由正极向负极移动
B.充电时的阳极反应为:LixC-xe-=C+xLi+
C.X可能为羧酸、醇等含活泼氢的有机物
D.锂离子电池的比能量(单位质量释放的能量)低
参考答案:B
本题解析:略
本题难度:一般
2、填空题 (19分)运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要意义;
(1)甲醇是重要的可再生燃料。已知在常温常压下:
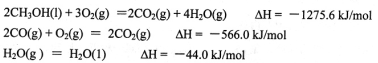
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_________。
(2)利用催化氧化反应将转化为是工业上生产硫酸的关键步骤.
①一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生上述反应,能说明该反应已达到平衡状态的是________。
a.体系的密度不发生变化
b.体系中硫元素的质量百分含量不再变化
c.SO2与SO3的体积比保持不变
d.容器内的气体分子总数不再变化
e.单位时问内转移4 mol电子,同时消耗2molSO3
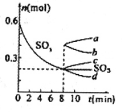
②T℃时,在1L密闭容器中充入0.6 molSO3,下图表示SO3物质的量随时间的变化曲线。达到平衡时,用SO2表示的化学反应速率为________;SO3的转化率为________(保留小数点后-位):T℃时,反应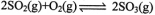 的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。
的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。
(3)有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。
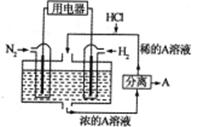
电池正极的电极反应式是_____电解质溶液的pH______(填写增大、减小、不变),A.物质是______(写化学式)。
参考答案:(1)CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ·mol-1
(2)①cd②0.05mol·L-1·min-1;66.7%;1.25L·mol-1;c
(3)N2+8H++6e-=2NH4+;增大;NH4Cl
本题解析:(1)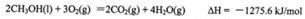 ①
①
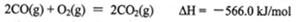 ②
②
 ③
③
ΔH=(①-②+4③)/2=(-1275.6+566.0-4×44.0)/2=-442.8kJ/mol
故热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)ΔH=-442.8kJ/mol
(2)①证明反应达到平衡状态的标志是各组分物质的量、物质的量浓度、体积分数、分子总数等不随时间的变化而变化,故选择cd。
②由图可知,当t=8min时反应达到平衡,那么v(SO3)=v(SO2)= =
=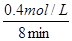 =0.05mol/(L?min)
=0.05mol/(L?min)
ω=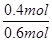 =
= =66.7%
=66.7%
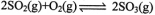
始000.6
转0.40.20.4
平0.40.20.2K= =1.25L/mol
=1.25L/mol
在8min时,压缩容器体积至0.5L,相当于增大压强,平衡向体积缩小的方向移动,即平衡向着生成SO3的方向移动,所以选择曲线c。
(3)以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,由图可知H2为负极,N2为正极,正极的电子,电极反应为N2+8H++6e-=2NH4+;由于H+被消耗,pH值增大;正极产生NH4+,与电解质溶液中的Cl-相结合,形成NH4Cl。
考点:热化学方程式的书写,化学反应速率与化学平衡,原电池的相关知识
本题难度:困难
3、简答题 (1)如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
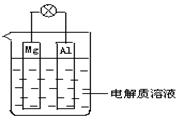
①电解质溶液为稀H2SO4时上述装置中灯泡亮,此时Al电极上发生反应的电极反应式为: ___?;
②电解质溶液为NaOH溶液时,灯泡______(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的电极反应式为:_______________?;
Al电极上发生反应的电极反应式为:_______________?;
b.若灯泡不亮,其理由为:________________________?。
(2)原电池原理的应用之一是可以设计原电池。请利用反应“Cu+2Fe3+ =2Fe2+ ?+Cu2+ ”设制一个原电池(正极材料用碳棒)则该电池的负极材料是?,若导线上转移电子1.5 mol,则溶解铜的质量是?。另外的重要应用是实验室在用锌与稀硫酸反应制备氢气时,可向溶液中滴加少量硫酸铜溶液。其作用是:?。
(3)氢氧燃料电池(电解质为KOH溶液,惰性材料作电极)负极反应的电极反应式为:
??。
参考答案:(1)①2H+ + 2e- = H2↑;
②亮? a. 6H2O + 6e- = 6OH- + 3H2↑;2Al – 6e- + 8OH- =2AlO2- + 4H2O。
(2)Cu;48g;形成了Zn—Cu原电池,加快了化学反应的速率(注:必须强调形成Zn—Cu原电池,否则不得分);(3)H2 +2 OH- - 2e-=2H2O
本题解析:结合装置图,当电解质溶液为稀H2SO4时上述装置中灯泡亮,判断Al片作正极,Mg片作负极,此时Al电极上发生反应的电极反应式:①2H+ + 2e- = H2↑
②电解质溶液为NaOH溶液时,判断Al片作负极,Mg片作正极,灯光亮,Mg电极上发生的电极反应式为
a.?6H2O + 6e- = 6OH- + 3H2↑;Al电极上发生反应的电极反应式为:2Al – 6e- + 8OH- =2AlO2- + 4H2O。
(2)结合Cu+2Fe3+ =2Fe2+ ?+Cu2+,可判断电池的负极材料是Cu片,失去电子,发生氧化反应,Cu-2e- =Cu2+ 若导线上转移电子1.5 mol,则溶解铜的质量是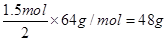 ,实验室在用锌与稀硫酸反应制备氢气时,可向溶液中滴加少量硫酸铜溶液的作用是Cu2++Zn=Zn2++Cu形成了Zn—Cu原电池,加快了化学反应的速率。
,实验室在用锌与稀硫酸反应制备氢气时,可向溶液中滴加少量硫酸铜溶液的作用是Cu2++Zn=Zn2++Cu形成了Zn—Cu原电池,加快了化学反应的速率。
(3)氢氧燃料电池(电解质为KOH溶液,惰性材料作电极)负极反应的电极反应式为H2 +2 OH- - 2e-=2H2O
点评:原电池构造原理是高中化学的重点也是难点,燃料电池是新兴的题型,考生要注意掌握原电池原理,把握本质,正确书写电极反应方程式。
本题难度:一般
4、选择题 科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下,下列说法错误的是
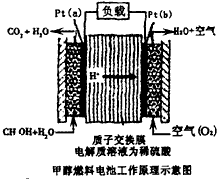
[? ]
A.a是负极,b是正极
B.b极的电反应是:O2+4H++4e-=2H2O
C.甲醇在a极上得电子,发生还原反应
D.当电路上通过2mol电子消耗的CH3OH为1/3mol
参考答案:C
本题解析:
本题难度:一般
5、选择题 使用氢氧燃料电池的公共汽车已在北京街头出现。某种以30%KOH溶液为电解质的氢氧燃料电池在使用时的电极反应如下:2H2+4OH--4e-==4H2O;O2 + 2H2O + 4e- === 4OH-。 下列有关该氢氧燃料电池的说法中,正确的是
[? ]
A.H2在正极发生氧化反应
B.供电时的总反应为:2H2 + O2 == 2H2O
C.氢氧燃料电池中H2和O2燃烧放出的热量转变为电能
D.氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池
参考答案:D
本题解析:
本题难度:一般