微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 使用单质铜制硝酸铜,耗用原料最经济,而且对环境几乎没有污染的是(?)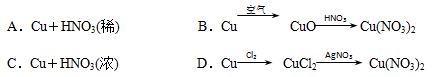
参考答案:B
本题解析:A、B、C、D发生的反应分别为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;2Cu+O2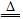 2CuO、CuO+2HNO3=Cu(NO3)2+H2O;Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;Cu+Cl2
2CuO、CuO+2HNO3=Cu(NO3)2+H2O;Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;Cu+Cl2 CuCl2、CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2。生成等物质的量的硝酸铜消耗硝酸最少的是方案B,而且B方案无污染。D方案需使用氯气,氯气是有毒气体而且硝酸银价格昂贵,不经济。
CuCl2、CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2。生成等物质的量的硝酸铜消耗硝酸最少的是方案B,而且B方案无污染。D方案需使用氯气,氯气是有毒气体而且硝酸银价格昂贵,不经济。
点评:评价化学实验方案的优劣一般考虑:有无污染、消耗原料多少、原料来源是否广泛、原料是否廉价等。
本题难度:一般
2、实验题 (16分)某化学课外活动小组设计实验探究氨气的化学性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
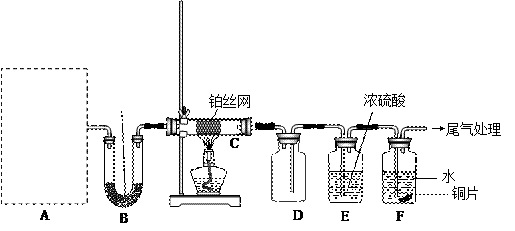
a. NH4HCO3? b. NH4Cl? c. Ca(OH)2? d. NaOH
 检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是_______(填代表备选试剂的字母);此时A中反应的化学方程式_______ ,A中主要的玻璃仪器有_______(填名称)。
(2)C中发生反应的化学方程式为_______,该反应是_________反应(填“吸热”或“放热”)。
(3)浓硫酸的作用____________________;铜片溶解的化学方程式_________________.
(4)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是_______ mol。
参考答案:

本题解析:略
本题难度:困难
3、选择题 碘和氧可以形成多种化合物,其中一种称为碘酸碘,在该化合物中碘元素呈+3和+5两种价态,这种化合物的化学式是( )
A.I2O3
B.I2O4
C.I4O7
D.I4O9
参考答案:D
本题解析:卤族元素多有变价,常见的有-1、+1、+3、+5、+7,能答此题的关键是碘酸碘三字,先写出碘酸根IO3-,此知识可由KClO3迁移而来,其中碘的化合价为+5,IO3-则是-1价,与之结合的应是+3价碘元素,又根据正价总数等于负价总数的原则,不难写出碘酸碘的化学式I(IO3)3。
本题难度:一般
4、计算题 在标准状况下,560体积氨气溶解在1体积的水中,求制得氨水中溶质的质量分数。若制得氨水的密度为0.91 g·cm-3,求氨水的物质的量浓度。
参考答案:氨水中溶质的质量分数为29.8%;溶液的物质的量浓度为15.95 mol·L-1。
同步测验
本题解析:有关氨水浓度的计算,首先应明确溶质是氨分子。
标准状况下560体积的氨可以假定体积为560 L,便于计算。560 L除以22.4 L·mol-1即得到氨的物质的量,再乘以氨的摩尔质量便求出溶质的质量。溶质质量加上1 L水的质量即为溶液质量。
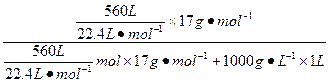 ×100%=29.8%
×100%=29.8%
知道氨水密度,再根据氨水的溶质质量分数便可以求出氨水的物质的量浓度。
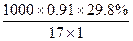 ?mol·L-1="15.95" mol·L-1
?mol·L-1="15.95" mol·L-1
本题难度:简单
5、填空题 (12分)某课外小组模拟工业流程,设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)。
(1)分别写出工业上用氨气制取NO及实验室用浓硝酸制取NO 的化学方程式:______________;___________________。
的化学方程式:______________;___________________。
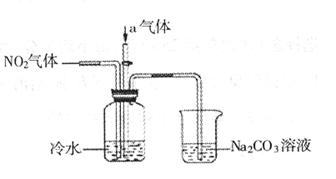
(2)连接好该装置后,首先进行的操作是:_____________________。
(3)通入的气体a是______________(填化学式),通入a的目的是:___________。
(4)盛有Na CO
CO 溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是:
溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是:
_______NO +_______Na
+_______Na CO
CO +_______H
+_______H O=NaNO
O=NaNO +_______+_______NaHCO
+_______+_______NaHCO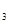 (完成此方程式)
(完成此方程式)
(5)用N O
O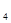 代替NO
代替NO 与水和a气体反应可生成硝酸,此反应的化学方程式是:
与水和a气体反应可生成硝酸,此反应的化学方程式是:
____________________________________。
参考答案:(12分)?(1)4NH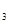 +5O
+5O
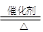 4NO+6H
4NO+6H O?(2分)
O?(2分)
Cu+4HNO3(浓)=Cu(NO3)2+2NO2 +2H2O(2分)
+2H2O(2分)
(2)检验装置的气密性(1分)
(3)O ?(1分)?可提高NO
?(1分)?可提高NO 的转化率(或2NO+O
的转化率(或2NO+O =2NO
=2NO )(2分)
)(2分)
(4)2NO2+2Na2CO3+1H2O=NaNO2+NaNO3+2NaHCO3(NaNO31分,系数1分)
(5)2N2O4+O2+2H2O=4HNO3(2分)
本题解析:(1)氨气发生催化氧化生成NO,反应的化学方程式是4NH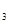 +5O
+5O
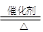 4NO+6H
4NO+6H O。实验室制取NO2常用浓硝酸和金属铜,反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2
O。实验室制取NO2常用浓硝酸和金属铜,反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2 +2H2O。
+2H2O。
(2)连接好该装置后,首先进行的操作应该是检验装置的气密性。
(3)由于NO2溶于水生成硝酸的同时,还生成NO,所以需要通入氧气氧化NO,再生成NO2,从而提高NO2的转化率。
(4)根据电子的得失守恒可配平该反应的化学方程式,即2NO2+2Na2CO3+H2O=NaNO2+NaNO3+2NaHCO3。
(5)N2O4和氧气溶于水生成硝酸,反应的化学方程式是2N2O4+O2+2H2O=4HNO3。
点评:该题是基础性试题的考查,考查的知识点比较多,但考查的都很基础,只要学生有扎实的基础以及灵活应变能力,即不能得出正确的答案。
本题难度:一般