微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,在密闭恒压容器中,能表示反应X(g)+2Y(g)

?2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1:2:2;②Z的浓度不再发生变化;③容器中的压强不再发生变化;④单位时间内生成n?molZ,同时生成2n?molY;⑤容器中的气体平均相对分子质量不再发生变化;⑥容器中气体的密度不再发生变化.
A.①②
B.①③⑤
C.②⑤⑥
D.②③⑤
参考答案:①平衡时各物质的物质的量与反应初始物质的量及转化率有关,和化学方程式的系数无关,故①错误;
②反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,所以Z的浓度不再变化时,该反应达到平衡状态,故②正确;
③该反应是反应前后气体体积有变化的反应,但是该反应是在恒压条件下发生,所以容器中的压强不再发生变化,不能证明达到了平衡状态,故③错误;
④单位时间内生成nmolZ,反应是向右进行的,同时生成2nmolY,则反应向左进行,但是正逆反应速率是不相等的,故④错误;
⑤容器中的气体平均相对分子质量M=mn,反应前后混合气体的质量始终不变,该反应是一个反应前后物质的量变化的反应,所以当M不再发生变化时,表明已经平衡,故⑤正确;
⑥该容器的压强保持不变,所以容积变,根据质量守恒定律知,反应前后混合气体的质量始终不变,所 以容器内气体的密度始终变,当容器中气体的密度不再发生变化时,表明达到化学平衡状态,故⑥正确.
故选C.
本题解析:
本题难度:一般
2、选择题 可以充分说明反应P(g)+Q(g)

R(g)+S(g)在恒温下已达到平衡的是( )
A.容积不变的反应容器内的密度不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体P、Q、R、S物质的量的浓度之比为1﹕1﹕1﹕1
参考答案:A、无论该反应是否达到平衡状态,容积不变的反应容器内的密度不随时间改变,故A错误;
B、无论该反应是否达到平衡状态,反应容器内P、Q、R、S四者都共存,故B错误.
C、当反应到达平衡,P的生成速率和P的消耗速率相等,而P的消耗速率和S的生成速率相等,所以P的生成速率和S的生成速率相等,故C正确;
D、反应达到平衡时,P、Q、R、S物质的量的浓度之比可能为1﹕1﹕1﹕1,也可能不是1﹕1﹕1﹕1,这与该反应的初始分子数及转化率有关,故D错误.
故选C.
本题解析:
本题难度:简单
3、填空题 (6分)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.09 mol·L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)=" a" mol·L-1。
(1)0min~4min内生成O2平均速率v(O2)= ?mol·L-1·min-1
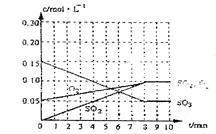
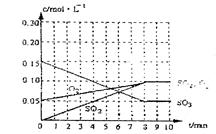
(2)达到平衡时c(O2)=c(SO2),则a=?mol·L-1,在下列坐标系中作出0min~8min及之后SO2、O2、SO3浓度随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是?
?
| A
| B
| C
| D
|
SO3
| 1mol
| 3mol
| 3mol
| 0mol
|
SO2
| 2mol
| 1.5mol
| 0mol
| 6mol
|
O2
| 2mol
| 1mol
| 0mol
| 5mol
参考答案:(1)? 0.01mol/L. min(1分)
(2) a="0.05" mol/L (1分) 图象如右(2分)
(3) BD
本题解析:?利用三行式求解
2SO3? ? 2SO2? +? O2
起始物质的量浓度? 3/20? 0? 1/20
变化物质的量浓度? 0.08? 0.08? 0.04
4Min物质的量浓度? 0.07? 0.08? 0.09?
所以(1)0min~4min内生成O2平均速率v(O2)= 0.01mol/L. min
利用三行式求解
2SO3? ? 2SO2? +? O2
起始物质的量浓度? 3/20? 0? 1/20
变化物质的量浓度? 2x?2x? x
8Min平衡物质的量浓度? a =0.15-2x? 2x? 0.05-? x?
达到平衡时c(O2)=c(SO2)即 2x? =? 0.05-? x?所以 x=0.05?所以a =0.15-2x=0.05
(2)达到平衡时c(O2)=c(SO2),则a="0.05" mol/L,在下列坐标系中作出0min~8min及之后SO2、O2、SO3浓度随时间变化曲线
点评:对于化学平衡的计算学生必须要掌握的知识有:三行式; 化学反应速率的计算公式:v=Δc/Δt ;等效平衡的三种情况:
I类:恒温恒容下对于反应前后气体体积发生变化的反应来说(即△V≠0的体系):等价转化后,对应各物质起始投料的物质的量与原平衡起始态相同。
II类:恒温恒容下对于反应前后气体体积没有变化的反应来说(即△V=0的体系):等价转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。
III类:恒温恒压下对于气体体系等效转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。
本题难度:一般
4、填空题 氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:3SiO2(s) + 6C(s) + 2N2(g) Si3N4(s) + 6CO(g) + Q(Q>0) Si3N4(s) + 6CO(g) + Q(Q>0)
完成下列填空:
(1)某温度下该反应在一容积为2L的密闭容器中进行,2min后达到平衡,刚好有2mol电子发生转移,则2min内反应的速率为:v(CO) = ?;该反应的平衡常数表达式为 ?。
(2)其它条件不变时仅增大压强,则?。
a.K值减小,平衡向逆反应方向移动?
b.K值增大,平衡向正反应方向移动
c.K值不变,平衡向逆反应方向移动?
d.K值不变,平衡向正反应方向移动
(3)一定条件下能说明上述反应已达平衡的是 ?。
a.c(N2 ) : c(CO) = 1:3? b.3v(N2 ) = v(CO)
c.固体质量不再改变? d.气体密度不再改变
达到平衡后改变某一条件,反应速率v与时间t的关系如图所示。?
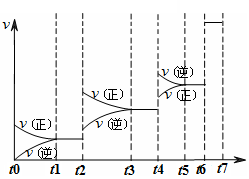
若不改变N2与CO的量,则图中t4时引起变化的原因可能是 ?;图中t6时引起变化的原因可能是?。
由图可知,平衡混合物中CO含量最高的时间段是?。
参考答案:(1)0.25mol/L·min(1分,计算或单位错不给分);?K=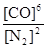 (1分)(2)c?(1分) (1分)(2)c?(1分)
(3)c、d(1分×2)33、升高温度或缩小体积(增大压强)(1分);加入了催化剂(1分)。
t3~t4(1分)。
本题解析:(1)可逆反应3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)的平衡常数k=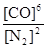 该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;(2)由方程式可知,该反应正反应是气体物质的量增大的反应,混乱度增大,熵值增大,故△S>0;故答案为:>;(3)A.单位时间生成2摩尔Si3N4的同时生成1摩尔的N2,生成2摩尔Si3N4的消耗4molN2,氮气的生成速率与消耗速率不相等,反应未达平衡状态,故A错误;B.平衡时c(N2)与c(CO)之比为1:3,可能处于平衡状态,也可能不处于平衡状态,与氮气的转化率等有关,故B错误;C.平衡时平衡体系个组分的含量不变,CO的百分含量保持不变,说明到达平衡状态,故C正确;D.单位时间消耗1摩尔SiO2的同时生成2摩尔的C,消耗1摩尔SiO2需要消耗2molC,C的生成速率与消耗速率相等,反应达平衡状态,故D正确;故选CD;(4)若不改变N2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为升高温度后压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂;t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;故答案为:升高温度后压缩体积增大压强;加入催化剂;t3~t4。 该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;(2)由方程式可知,该反应正反应是气体物质的量增大的反应,混乱度增大,熵值增大,故△S>0;故答案为:>;(3)A.单位时间生成2摩尔Si3N4的同时生成1摩尔的N2,生成2摩尔Si3N4的消耗4molN2,氮气的生成速率与消耗速率不相等,反应未达平衡状态,故A错误;B.平衡时c(N2)与c(CO)之比为1:3,可能处于平衡状态,也可能不处于平衡状态,与氮气的转化率等有关,故B错误;C.平衡时平衡体系个组分的含量不变,CO的百分含量保持不变,说明到达平衡状态,故C正确;D.单位时间消耗1摩尔SiO2的同时生成2摩尔的C,消耗1摩尔SiO2需要消耗2molC,C的生成速率与消耗速率相等,反应达平衡状态,故D正确;故选CD;(4)若不改变N2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为升高温度后压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂;t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;故答案为:升高温度后压缩体积增大压强;加入催化剂;t3~t4。
本题难度:困难
5、选择题 对可逆反应4NH3(g)+5O2(g)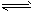 4NO(g)+6H2O(g),下列叙述正确的是 4NO(g)+6H2O(g),下列叙述正确的是
[? ]
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若减小压强,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是2v正(NH3)=3v正(H2O)
参考答案:A
本题解析:
本题难度:一般
|