微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 物质在反应中可表现氧化性、还原性、酸性、碱性等,下面方程式中划线的物质,能在同一反应中同时表现上述两种或两种以上性质的有
①3FeO + 10HNO3= 3Fe(NO3)3 + NO? + 5H2O
②C + 2H2SO4 (浓) = CO2?+ 2SO2?+ 2H2O
③8NH3 + 3Cl2 = 6NH4Cl + N2
④2Na2O2 + 2H2O =" 4NaOH" + O2
A.①②
B.①④
C.③④
D.全部
参考答案:B
本题解析:①HNO3体现了氧化性和酸性;②只体现氧化性;③只体现氧化性;④体现了氧化性和还原性。因此答案为B。
点评:对于氧化还原反应的解答,应掌握氧化还原反应中涉及的相关概念。如“氧化剂、还原剂、还原产物、氧化产物”等。属于基础题。
本题难度:一般
2、简答题 某抗酸药每片含有碳酸钙540mg,氢氧化镁180mg.
(1)写出该抗酸药发挥功效时的化学反应方程式.
(2)该药片中的碳酸钙和氢氧化镁哪种物质中和的胃酸(以盐酸计)多?
参考答案:(1)该抗酸药发挥功效时的化学反应方程式是和胃酸中的盐酸反应,化学方程式为:CaCO3+2HCl═CaCl2+CO2↑+H2O、Mg(OH)2+2HCl═MgCl2+2H2O;
答:该抗酸药发挥功效时的化学反应方程式为CaCO3+2HCl═CaCl2+CO2↑+H2O、Mg(OH)2+2HCl═MgCl2+2H2O;
(2)依据化学方程式的定量关系计算:540mg碳酸钙的物质的量为0.0054mol,可中和的盐酸为0.0108mol;180mg氢氧化镁的物质的量为0.0033mol,可中和的盐酸为0.0066mol,所以碳酸钙中和的盐酸多;
答:碳酸钙中和的盐酸多.
本题解析:
本题难度:一般
3、简答题 把6.5g?锌粉放入足量的盐酸中,锌完全反应.试计算:
(1)6.5g锌的物质的量______;
(2)参加反应的氯化氢的物质的量______;
(3)生成氢气的体积(标准状况)______.
参考答案:(1)6.5g锌的物质的量为6.5g65g/mol=0.1mol,
故答案为:0.1mol;
(2)令参加反应的HCl为xmol,则:
? Zn+2HCl=ZnCl2+H2↑
? 1? 2
0.1mol?x
故x=0.2mol,
故答案为:0.2mol;
(3)令生成的氢气物质的量为ymol,则:
? Zn+2HCl=ZnCl2+H2↑
? 1? 1
0.1mol? y
故y=0.1mol,
所以生成氢气的体积为0.1mol×22.4L/mol=2.24L,
故答案为:2.24L.
本题解析:
本题难度:一般
4、选择题 下列化学用语表示正确的是
A.CO2的比例模型:
B.铝离子的结构示意图:
C.次氯酸的结构式:H-Cl-O
D.甲基的电子式: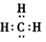
参考答案:A
本题解析:B、铝的核电荷数为13,错误;C、次氯酸的结构式为H—O—Cl,错误;D、甲基的碳上应有一个单电子,错误。
本题难度:一般
5、选择题 将镁、铝合金10.2 g 溶于4 mol·L-1的盐酸500 mL 里,若加入2 mol·L-1的氢氧化钠溶液,并使得沉淀达到最大量,则需加入此种氢氧化钠溶液为(? )
A.1000 mL
B.500 mL
C.100 mL
D.1500 mL
参考答案:A
本题解析:当镁铝合金溶于盐酸后,溶液中含有Al3+、Mg2+、H+,若与NaOH反应时,H+先反应,当沉淀量达到最大时,消耗NaOH的物质的量等于盐酸的物质的量,所以4 mol·L-1×0.5 L=2 mol·L-1×V,V=1 L=1000 mL,A项正确。
本题难度:一般