微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应燃烧的热化学方程式是
____________________________________________________
(2)如图是298 K时N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:_________________________________。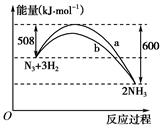
参考答案:(1)S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1
(2)N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1
本题解析:(1)16 g固体硫是0.5mol,所以反应燃烧的热化学方程式是S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1。
(2)由图可知反应放出的能量是600-508=92 kJ,故热化学方程式为N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1。
本题难度:简单
2、填空题 红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据下图回答下列问题:
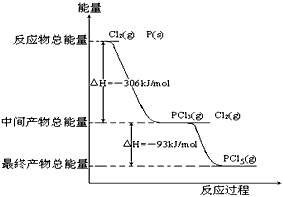
(1)P和Cl2反应生成PCl3的热化学方程式___________________________ ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式_____________________________ ;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于_____________;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2 ________α1 (填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_______________________;
(4)P和Cl2分两步反应生成1mol PCl5的△H3=________________________ 。
参考答案:(1)2P(s)+3Cl2(g)=2PCl3(g) △H=-612kJ/mol
(2)PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ/mol ;25% ;大于
(3)因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成。
(4)-399kJ/mol
本题解析:
本题难度:一般
3、填空题 (9分)发射卫星时可用肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g) +2 O2(g) = 2NO2(g);△H=+67.7kJ·mol-1
N2H4(g) + O2(g) = N2(g) + 2H2O(g);△H=-534kJ·mol-1
1/2H2(g) + 1/2F2(g) = HF(g);△H=-269kJ·mol-1
H2(g) + 1/2O2(g) = H2O(g);△H=-242kJ·mol-1
(1)肼和二氧化氮反应的热化学方程式为?;此反应用于火箭推进,除释放大量能量和快速产生气体外,还有一个很大的优点是:__________?。
(2)有人认为若用氟气代替二氧化氮作氧化剂,则反应释放的能量更大。肼和氟气反应的热化学方程式为? ___。
参考答案:(1) N2H4(g) + NO2(g) = 3/2 N2(g) + 2H2O(g)?△H=-567.9kJ·mol-1
产物为N2和H2O,对环境无污染。
(2) N2H4(g) +2 F2(g) = N2(g) + 4 HF(g);△H=-1126kJ·mol-1
本题解析:(1)考查盖斯定律的应用。根据反应①N2(g) +2 O2(g) = 2NO2(g)和反应②N2H4(g) + O2(g) = N2(g) + 2H2O(g)可知,②-1/2①即得到 N2H4(g) + NO2(g) = 3/2 N2(g) + 2H2O(g),所以反应热是―534kJ·mol-1―67.7kJ·mol-1×1/2=-567.9kJ·mol-1。根据方程式可知,生成物是氮气和水,对环境无污染。
(2)根据反应③1/2H2(g) + 1/2F2(g) = HF(g)和反应④可知,③×4-④×2+②即得到N2H4(g) +2 F2(g) = N2(g) + 4 HF(g),所以反应热是-269kJ·mol-1×4+242kJ·mol-1×2-534kJ·mol-1=-1126kJ·mol-1。
本题难度:一般
4、选择题 利用相关数据作出的推理或判断一定正确的是
A.用弱酸的电离常数比较相同条件下强碱弱酸盐溶液的碱性强弱
B.用物质的熔沸点数据推断物质的晶体类型
C.根据溶液的pH判断该溶液的酸碱性
D.根据焓变数据判断反应能否自发进行
参考答案:A
本题解析:B:金属晶体的熔沸点范围很大,甚至一些分子晶体的熔沸点都高于它,但钨的熔沸点特别高,原子晶体都没有它高。C:溶液的酸碱性决定于溶液中c(H+)与c(OH—)的相对大小,与pH没有直接的关系;D:自发反应主要决定于自由能的大小△G=△H-T△S
本题难度:简单
5、选择题 化学反应A2+B2====2AB的能量变化如图所示,则下列说法正确的是( )
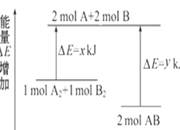
A.该反应是吸热反应
B.断裂1 mol A—A键和1 mol B—B键能放出x kJ能量
C.断裂2 mol A—B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
参考答案:C
本题解析:根据图像可知,反应物的总能量高于生成物额总能量,因此是放热反应,A、D不正确;断键是吸热的,B不正确,C正确,答案选C。
本题难度:一般