微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+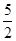 O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ/mol 的说法中,正确的是(? )
O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ/mol 的说法中,正确的是(? )
A.当转移10NA个电子时,该反应放出1300 kJ的能量
B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量
C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量
参考答案:AD
本题解析:C2H2(g)+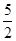 O10e-2(g)=2CO2(g)+H2O(l)ΔH=-1 300 kJ/mol,当有10 mol 电子转移时,生成1 mol液态水,生成2 mol CO2(O==C==O),其中含8 mol碳氧共用电子对,放出1 300 kJ的能量。
O10e-2(g)=2CO2(g)+H2O(l)ΔH=-1 300 kJ/mol,当有10 mol 电子转移时,生成1 mol液态水,生成2 mol CO2(O==C==O),其中含8 mol碳氧共用电子对,放出1 300 kJ的能量。
本题难度:一般
2、选择题 将Ba(OH)2·8H2O晶体与NH4Cl晶体混合,能表示反应过程中能量变化的示意图是
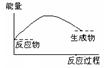 ?
? ?
? ?
?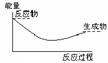
A?B?C?D
参考答案:A
本题解析:略
本题难度:简单
3、选择题 下列说法或表示方法中正确的是
A.等质量的硫蒸气和硫磺固体分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=+571.6 kJ·mol-1
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D.已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的溶液与含1 mol NaOH的溶液混合,放出的热量可能大于57.3 kJ
参考答案:D
本题解析:由于气态硫的能量高于固态硫的能量,所以气态硫燃烧放出的热量多,选项A不正确;氢气燃烧是放热反应,△H小于0,选项B不正确;选项C不正确,因为该反应是吸热反应,△H大于0;由于浓硫酸溶于水会放出大量的热量,因此选项D正确,答案选D。
本题难度:一般
4、选择题 白磷与氧可发生如下反应:P4 + 5O2 = P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
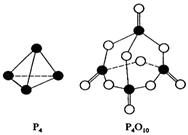
A.(6a+5d-4c-12b)kJ·mol-1
B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1
D.(4a+5d-4c-12b)kJ·mol-1
参考答案:A
本题解析:各化学键键能为P-P a kJ?mol-1、P-O b kJ?mol-1、P="O" c kJ?mol-1、O="O" d kJ?mol-1.
反应热△H=反应物总键能-生成物总键能,
所以反应P4+5O2=P4O10的反应热△H=6akJ?mol-1+5dkJ?mol-1-(4ckJ?mol-1+12bkJ?mol-1)=(6a+5d-4c-12b)kJ?mol-1,
故选:A。
点评:考查反应热与化学键键能的关系,难度中等,注意从物质能量、键能理解反应热。
本题难度:简单
5、选择题 氢气和氟气混合在黑暗处即可发生爆炸而释放出大量的热量。在反应过程中,断裂1molH2中的化学键消耗的能量为Q1kJ,断裂1molF2中的化学键消耗的能量为Q2kJ,形成1molHF中的化学键释放的能量为Q3kJ。下列关系式中正确的是?
A.Q1+ Q2<2Q3
B.Q1+ Q2>2Q3
C.Q1+ Q2<Q3
D.Q1+ Q2>Q3
参考答案:A
本题解析:
本题从微观的角度考查反应热的计算。在化学反应中,断键需要吸热,而形成新的化学键时则会放出能量。氢气在氯气中燃烧属于放热反应,化学方程式为: 所以反应中放出的能量为:2Q3-Q1+ Q2,因此Q1+ Q2< 2Q3,即选项A符合题意。
所以反应中放出的能量为:2Q3-Q1+ Q2,因此Q1+ Q2< 2Q3,即选项A符合题意。
本题难度:一般