微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在容积固定不变的密闭容器中加入1?mol?N2和3?mol?H2发生反应:N2(g)+3H2(g) 2NH3(g) ?△H=-92.4?kJ/mol,下列结论正确的是
2NH3(g) ?△H=-92.4?kJ/mol,下列结论正确的是
[? ]
A.该反应达到平衡时,放出的热量等于92.4?kJ
B.达到平衡后向容器中通入1?mol氦气,平衡不移动
C.降低温度和缩小容器体积均可使该反应的平衡常数增大
D.若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的80%
参考答案:BD
本题解析:
本题难度:一般
2、填空题 已知,常温下1体积水能溶解2体积氯气,并且氯水中有如下平衡:Cl2 + H2O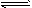 HCl + HClO
HCl + HClO
(1)常温下,在一个体积为100mL的透明玻璃针筒里吸入80mL氯气后,再吸进10mL水,振荡后静置。写出针筒中观察到的现象是_____________________。
(2)将上述针筒长时间放置,又能看到何种变化__________;试用平衡观点加以解释__________。
参考答案:(1)气体体积缩小,溶液呈浅黄绿色
(2)气体体积继续减小(至约40 mL),气体和溶液的颜色均逐渐变浅(直至无色);氯水中存在平衡
Cl2 + H2O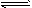 HCl + HClO,由于2HClO == 2HCl + O2↑,HClO不断分解,使上述平衡右移,最终Cl2耗尽全部转化为O2,由总关系式为:2Cl2~O2
HCl + HClO,由于2HClO == 2HCl + O2↑,HClO不断分解,使上述平衡右移,最终Cl2耗尽全部转化为O2,由总关系式为:2Cl2~O2
本题解析:
本题难度:一般
3、选择题 对于可逆反应N2(g)+3H2(g)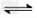 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
[? ]
A、压强对反应的?影响(P2>P1)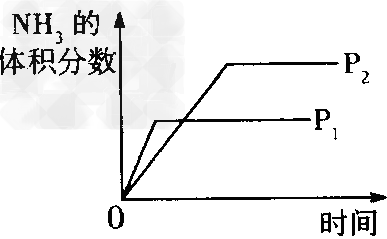
B、温度对反应的影响? ? 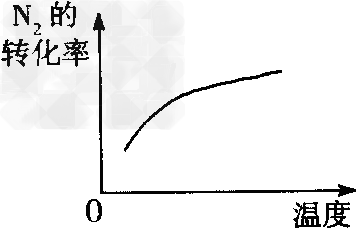
C、增加N2的浓度对反应的影响? 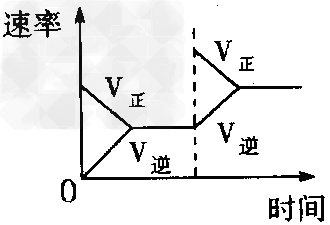
D、催化剂对反应的影响? ? 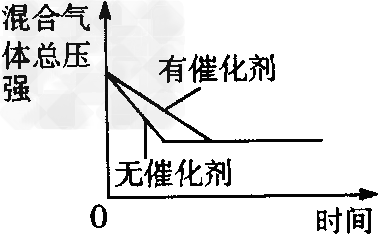
|
参考答案:C
本题解析:
本题难度:一般
4、填空题 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为:_________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:______________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)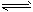 CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)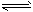 CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)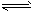 CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)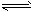 CH3OCH3(g) + CO2(g)的ΔH= ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
CH3OCH3(g) + CO2(g)的ΔH= ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)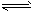 CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
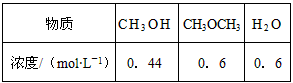
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率
v(CH3OH) = __________。
参考答案:(1)C+H2O CO+H2
CO+H2
(2)Na2CO3+H2S==NaHCO3+NaHS
(3)-246.4kJ· mol-1;ce
(4)①>;②0.04mol·L-1;0.16mol·L-1·min-1
本题解析:
本题难度:困难
5、选择题 下列反应达到平衡后,加压或降温平衡都向正反应方向移动的是( )
A.2SO2(g)+O2(g)?2SO3(g)?(正反应为放热反应)
B.PCl5(g)?PCl3(g)+Cl2(g)(正反应为吸热反应)
C.N2(g)+3H2(g)?2NH3(g)?(正反应为放热反应)
D.2O3(g)?3?O2(g)?(正反应为放热反应)
参考答案:A.反应物气体的化学计量数之和大于生成物气体的化学计量数之和,加压向正反应方向移动,正反应为放热反应,降温平衡向正反应方向移动,故A正确;
B.反应物气体的化学计量数之和小于于生成物气体的化学计量数之和,加压平衡向逆反应方向移动,正反应为吸热反应,降温向逆反应方向移动,故B错误;
C.反应物气体的化学计量数之和大于生成物气体的化学计量数之和,加压向正反应方向移动,正反应为放热反应,降温平衡向正反应方向移动,故C正确;
D.反应物气体的化学计量数之和小于于生成物气体的化学计量数之和,加压平衡向逆反应方向移动,故D错误.
故选AC.
本题解析:
本题难度:简单